氨基酸代谢
蛋白质代谢
蛋白质代谢特点
蛋白质的代谢属于含氮分子的代谢,本质涉及到人体内的氮平衡。
蛋白质的消化
蛋白质本身属于大分子,消化后分解为小分子便于吸收,并且蛋白质具有种属特异性和免疫原性,消化后可以防止过敏与毒性反应。
消化蛋白质的部位主要集中在胃和肠道,主要由胃酸+胃蛋白酶、胰蛋白酶+胰凝乳蛋白酶+弹性蛋白酶+羧肽酶与小肠粘膜细胞蛋白酶(氨肽酶+二肽酶+三肽酶)。
蛋白质从我们的食道滑入胃部,蛋白质的消化正式开始。
- 率先登场的是胃酸,极低的pH让蛋白质变性,使其高级结构崩塌;胃蛋白酶趁热打铁,作为非专一蛋白酶,在pH=2时候活性最强,主要水解芳香族氨基酸羧基端所形成的肽键。主要产物为多肽碎片与少量氨基酸。
- 穿过幽门进入十二指肠,一刻也没有为胃蛋白酶的消逝而悲伤,接下来登场的是胰腺消化液!其包含的碳酸氢钠使得pH稳定在7左右,包含的胰蛋白酶+胰凝乳蛋白酶+弹性蛋白酶+羧肽酶对多肽碎片重拳出击,获得寡肽与少量氨基酸。
- 在曲折的小肠里,剩下的寡肽会在氨肽酶+二肽酶+三肽酶的催化下被消化为氨基酸,只剩下一些顽固分子(比如角蛋白)会随着消化残渣排出体外。
消化的产物主要是2/3的寡肽(2-3肽)与1/3的氨基酸。
内肽酶与外肽酶
- 内肽酶:破坏肽链的非末端氨基酸肽键,不产生氨基酸,常见的有
- 胰蛋白酶
- 胰凝乳蛋白酶
- 弹性蛋白酶
- 外肽酶:水解肽链末端氨基酸的肽键,产生氨基酸。
- 羧肽酶A
- 羧肽酶B
- 氨肽酶
- 二肽酶
氨基酸、二肽与三肽的吸收
体内蛋白质的降解
氨基酸分解代谢
Note
仅有在以下三种情况才会氧化分解氨基酸:
- 消化吸收的氨基酸超出身体需要
- 蛋白质正常合成降解时产生的不再需要的边角料氨基酸
- 机体饥饿状态(包括未控制的糖尿病)时
首先要回顾一下我们体内的20种氨基酸,包括必需和非必需的氨基酸:
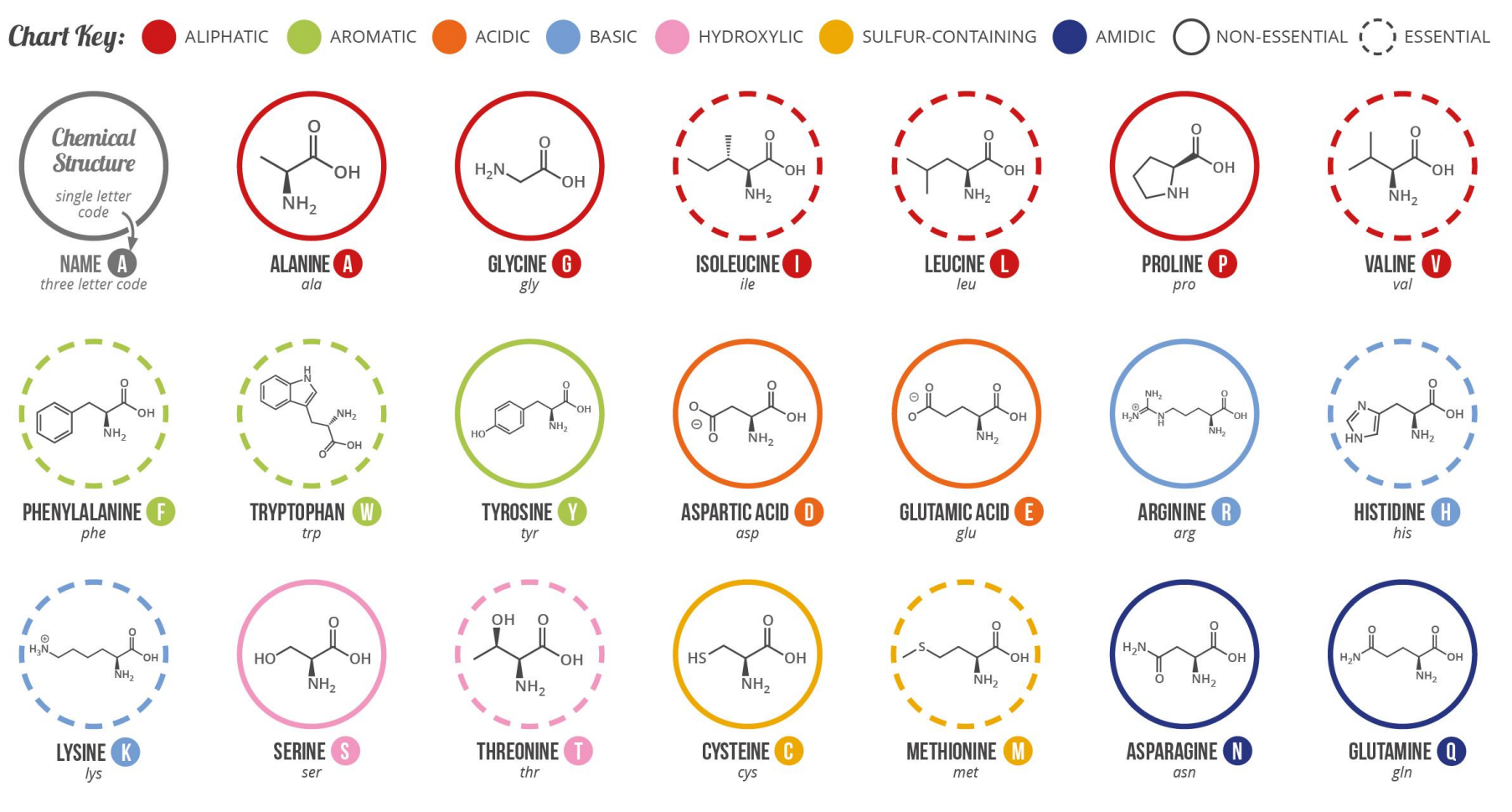
氨基酸的代谢要解决两个代谢问题:氨基的代谢或碳骨架代谢。
转氨基有三种主要方法:转氨基、氧化脱氨与联合脱氨,也有其他方式(L-氨基酸氧化酶或丝氨酸/苏氨酸脱水酶)。
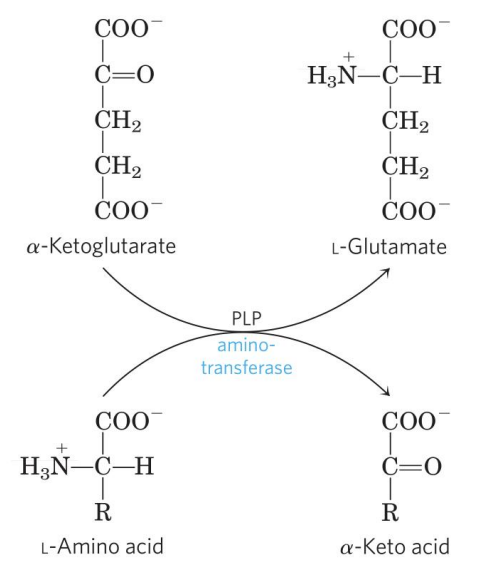
转氨基
转氨基作用是指某种α-氨基酸在转氨酶的催化下,脱掉α-氨基生成α-酮酸,而另一个α-酮酸则获得这个氨基生成α-氨基酸的可逆过程。除了Lys,Pro与Hyp(羟脯氨酸,在胶原蛋白中)外,大部分氨基酸都可以发生转氨基作用。
体内常见的转氨基搭子:
- 丙酮酸与丙氨酸
- 草酰乙酸与天冬氨酸
- α-酮戊二酸与谷氨酸
转氨基作用是体内大多数氨基酸脱氨基的重要方式,也是合成非必需氨基酸的重要途径。
转氨酶
转氨基反应是可逆的,过程由转氨酶催化,发生于多对氨基酸与α-酮酸之间的每一种反应都由一个特定的转氨酶催化。其中最常见的是α-酮戊二酸作为氨基受体,接受氨基转变为谷氨酸。
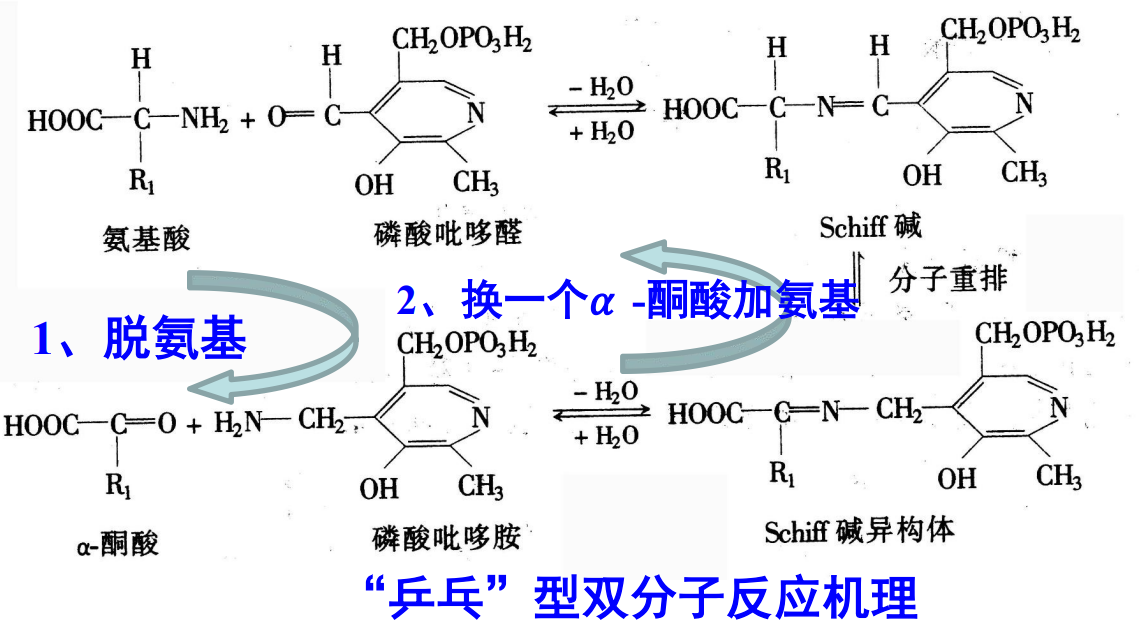
但是无论如何,所有转氨酶都遵循相同的一套作用机制——“乒乓”型双分子反应机理与相同的辅酶——磷酸吡哆醛(维生素B6)
转氨酶广泛分布于各组织中,肝、心脏中含量最丰富。
氧化脱氨
联合脱氨
氨的代谢
氨的来源
体内的氨可能来自于:
- 氨基酸脱氨基作用和胺类的分解均可以产生氨:$$ \ce{{RCH2NH2}\overset{胺氧化酶}{\longrightarrow}RCHO + NH3}$$
- 肠道细菌腐败作用产生氨
- 氨基酸在肠道细菌作用下产生的氨
- 尿素经肠道细菌尿素酶水解产生的氨
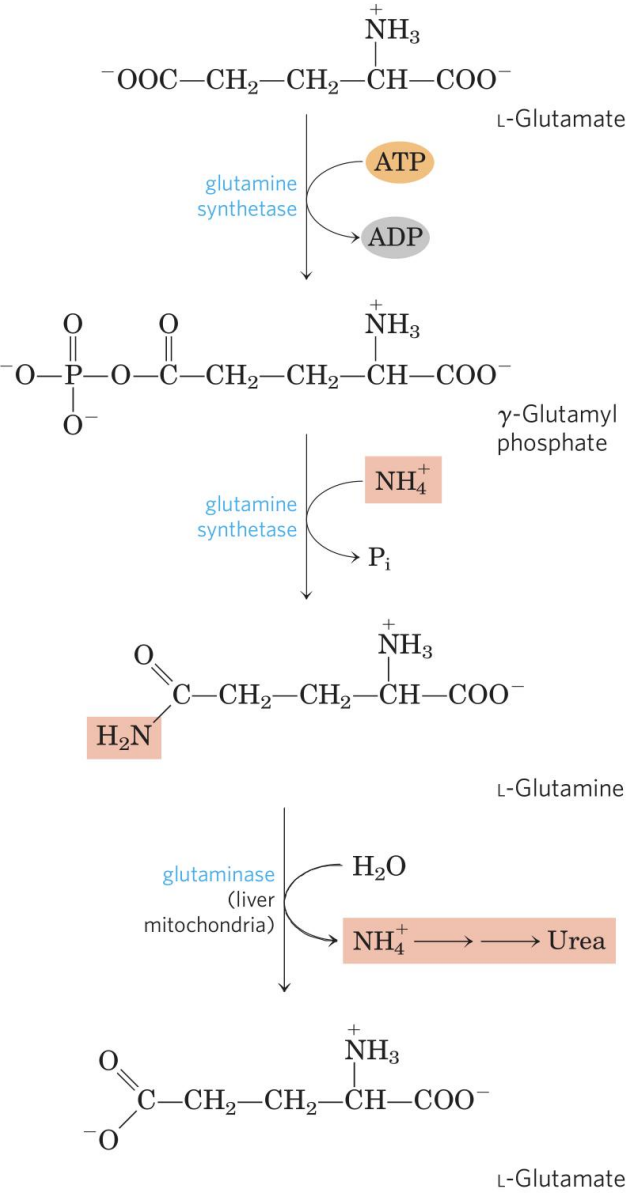
- 肾小管上皮细胞分泌的氨主要来自于谷氨酰胺:$$ \ce{谷氨酰胺 \overset{谷氨酰胺酶}{\longrightarrow}谷氨酸+NH3} $$
- 嘌呤核苷酸循环
氨的毒性
氨分子是机体的正常代谢产物,具有毒性。体内的氨主要在肝合成尿素而解毒(哺乳动物不能排氨)细胞膜能通透氨分子但不能通透铵根离子正常人血氨浓度一般不超过60 μmol/L
氨的血液运输
由于大部分氨需要运输到肝脏才能生成尿素解毒,但氨的产生主要在肝外组织(肌肉,大脑等),所以如何妥当的把这群“体内危化品”安全稳当运输到肝组织里解毒是一个很头疼的问题。
借助血液运输快速便捷,机体通过以下两个途径使得氨以无毒的形式在血液中转运:
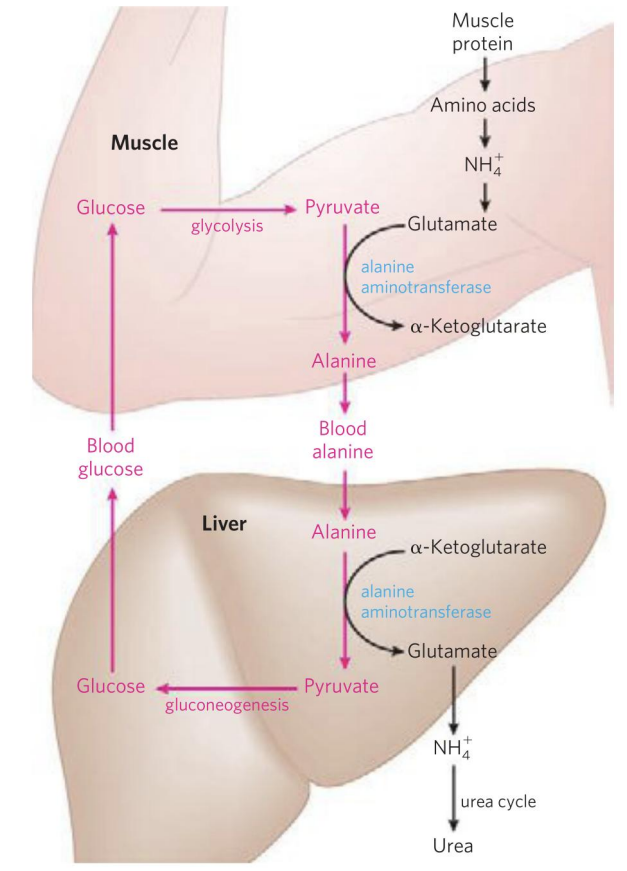
- 丙氨酸-葡萄糖循环(alanine-glucose cycle)
- 通过谷氨酰胺转运
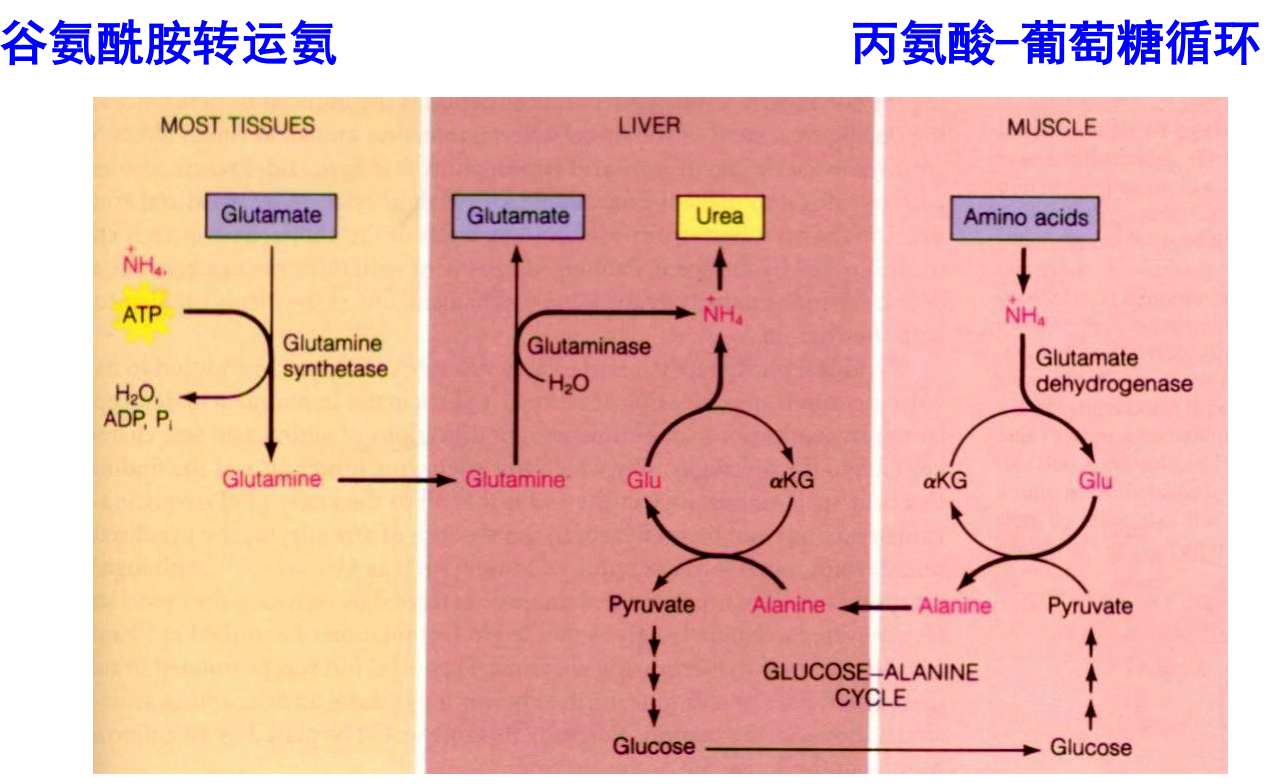
谷氨酰胺形式的运输
许多组织采用谷氨酰胺的形式转运氨。
丙氨酸-葡萄糖循环的运输
剧烈运动时候肌肉蛋白质降解生成大量\(\ce{NH+4}\)并转化为谷氨酸,同时葡萄糖无氧氧化大量生成丙酮酸。
为了解决这两家伙(丙酮酸无氧状态只能转化为乳酸,这也是个麻烦家伙),肌肉组织决定借助谷丙转氨酶,将谷氨酸的氨基转给丙酮酸生成α-酮戊二酸和丙氨酸。
丙氨酸通过血液循环进入肝脏,将氨基交给α-酮戊二酸,生成丙酮酸和谷氨酸。肝脏将丙酮酸塞入糖异生,而谷氨酸脱氨基生成尿素。
氨的去向
- 用于含氮物质(包括非必需氨基酸)的生物合成
- 合成谷氨酰胺在血液中运输
- 多数的氨最终在肝脏中转化为尿素(urea)排泄出体外
- 少量参与肾小管排氢保钠,中和酸以 \(\ce{NH+4}\) 形式排泄出体外在长期依靠脂肪与氨基酸供能时,酸与氨同时中毒且低血糖,左图所示排氢保钠过程最为活跃,实现排氨,排酸,糖异生三赢,总氮中的大部分都以 \(\ce{NH+4}\) 而非尿素形式排出。
尿素循环 / 鸟氨酸循环
尿素循环是人体内氨的主要去路,参与维持血氨的低水平。尿素循环的主要发生部位是肝细胞线粒体与细胞质
其概览如下:
- 原料:\(\ce{NH3,CO2,ATP}\),天冬氨酸。2个氮原子1个来自氨1个来自天冬氨酸
- 涉及的氨基酸及其衍生物:6种,包括鸟氨酸、瓜氨酸、天冬氨酸、精氨酸代琥珀酸、精氨酸、N-乙酰谷氨酸
- 限速酶:精氨酸代琥珀酸合酶,氨基甲酰磷酸合酶I(CPS I)
- 耗能:3个ATP(4个高能磷酸键,2 ATP在氨基甲酰磷酸生成时消耗,1 ATP的2个高能磷酸键在精氨酸代琥珀酸生成时消耗)
- 与三羧酸循环的联系物质:延胡索酸
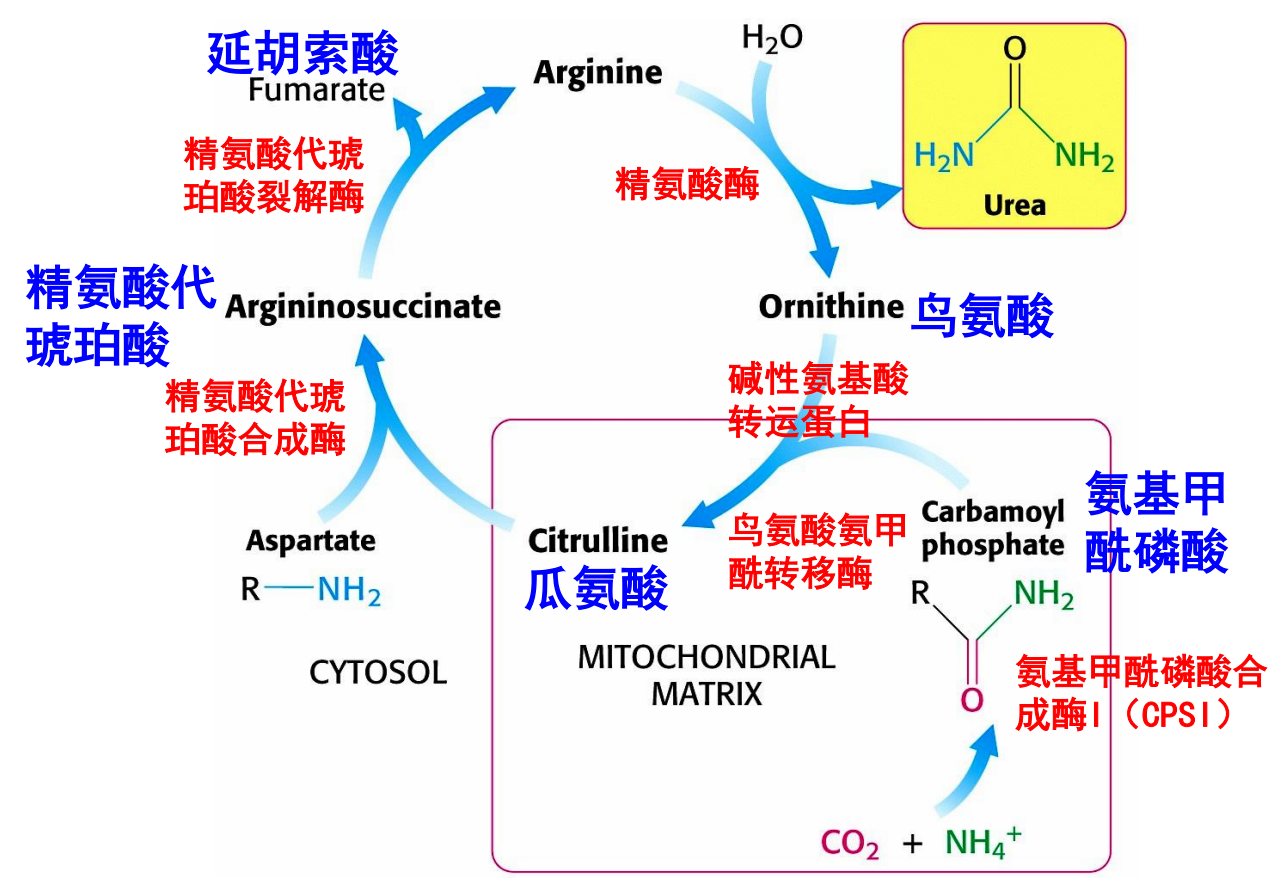
一开始,精氨酸在精氨酸酶的作用下催化生成尿素与鸟氨酸。
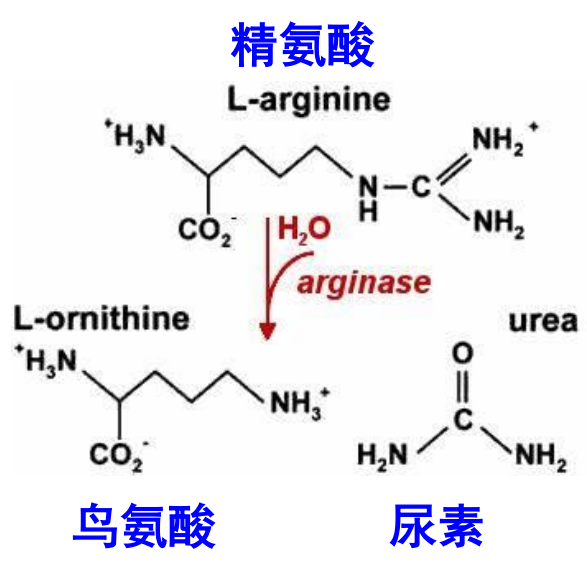
但是长此以往,对精氨酸会有巨大的消耗,所以接下来的循环步骤是为了将鸟氨酸转化回精氨酸。
鸟氨酸和精氨酸之间差了一个尿素,也就是一个碳和两个氨基。首先是在鸟氨酸甲酰转移酶的催化下,获得一个碳和一个氨基。
之后在精氨酸代琥珀酸合成酶与精氨酸代琥珀酸裂解酶的催化下,从天冬氨酸上获得一个氨基,后者转化为延胡索酸。
在这一次循环中一共涉及了肝细胞的两个亚细胞部位,鸟氨酸接受氨基甲酰磷酸成为瓜氨酸的部位在线粒体基质。
之后从天冬氨酸处接受一个氨基,精氨酸分解出一个尿素的过程在细胞质基质中进行。
天冬氨酸的转化产物延胡索酸会被转化为苹果酸后通过天冬氨酸-苹果酸穿梭系统回到线粒体基质中参与三羧酸循环。
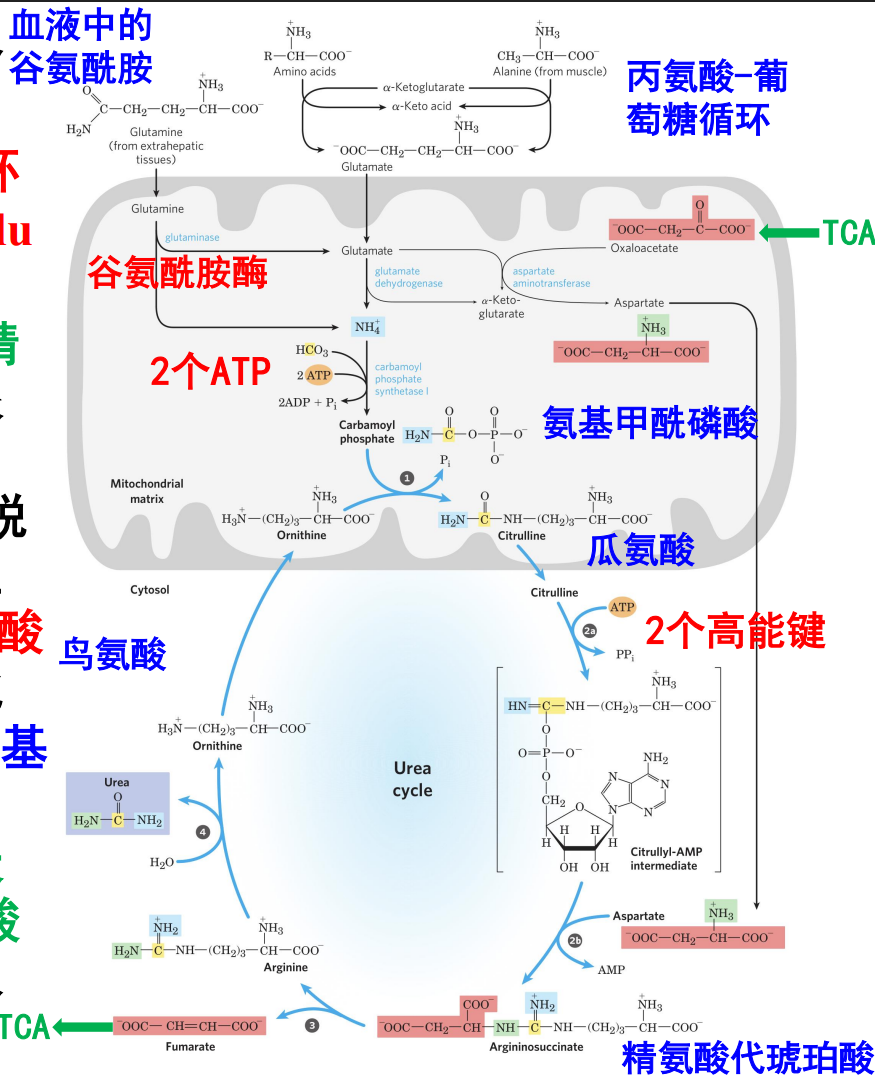
尿素循环的调节与相关疾病
氨基酸碳骨架的命运
氨基酸脱氨基后成为α-酮酸有三种主要途径:
- 经氨基酸生成非必需氨基酸
- 进入三羧酸循环(生糖与生酮氨基酸均可)
- 转变为糖类以及脂类。
生酮氨基酸与生糖氨基酸
- 生酮氨基酸代谢生成乙酰-CoA或者酮体
- 生糖氨基酸代谢生成三羧酸中间产物或丙酮酸。
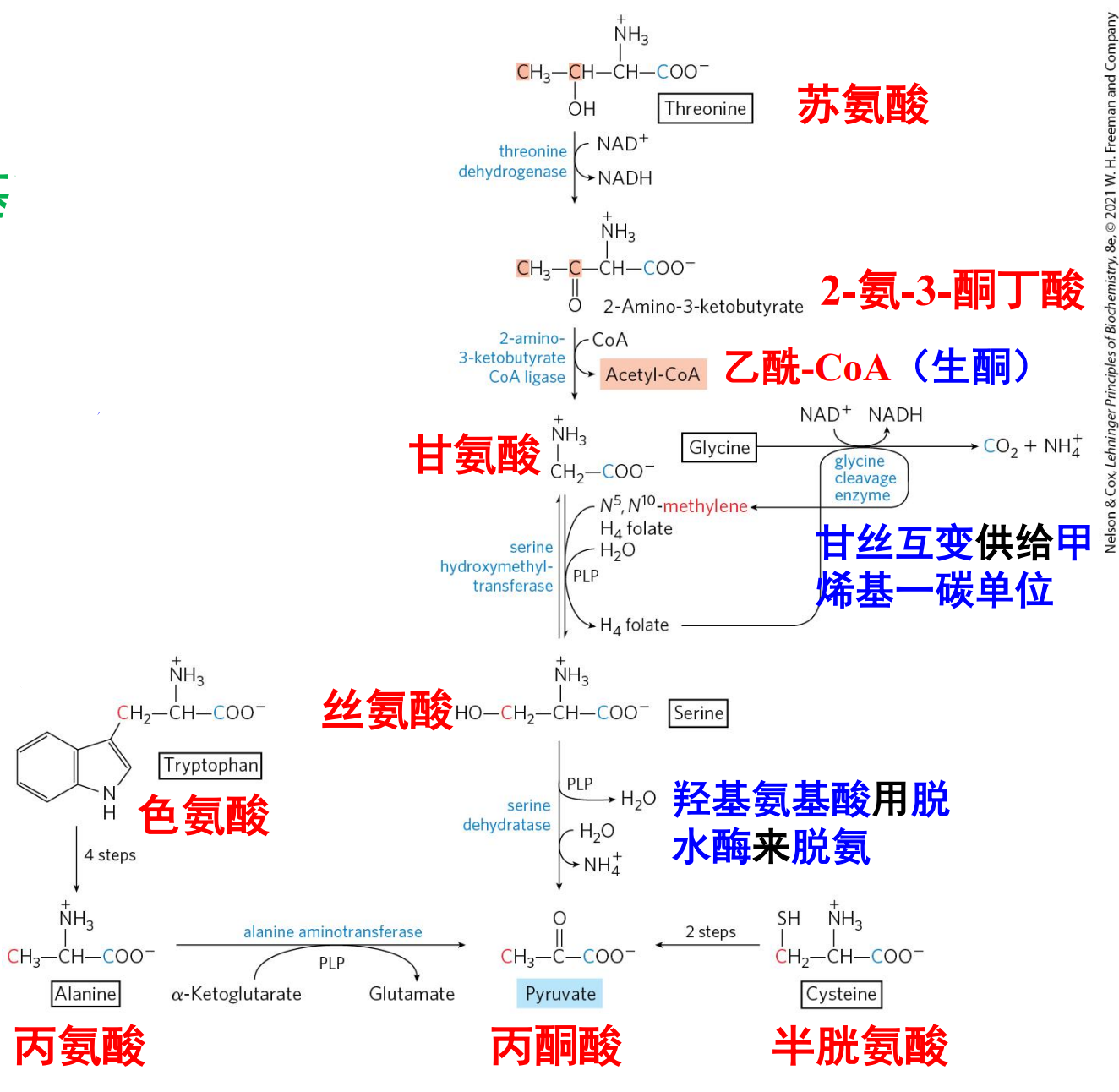
生成丙酮酸
生成丙酮酸的氨基酸均属于生糖氨基酸,包括:Ala, Cys, Gly, Ser与生糖兼生酮的Thr, Trp。
核心步骤是甘氨酸与丝氨酸的互变。
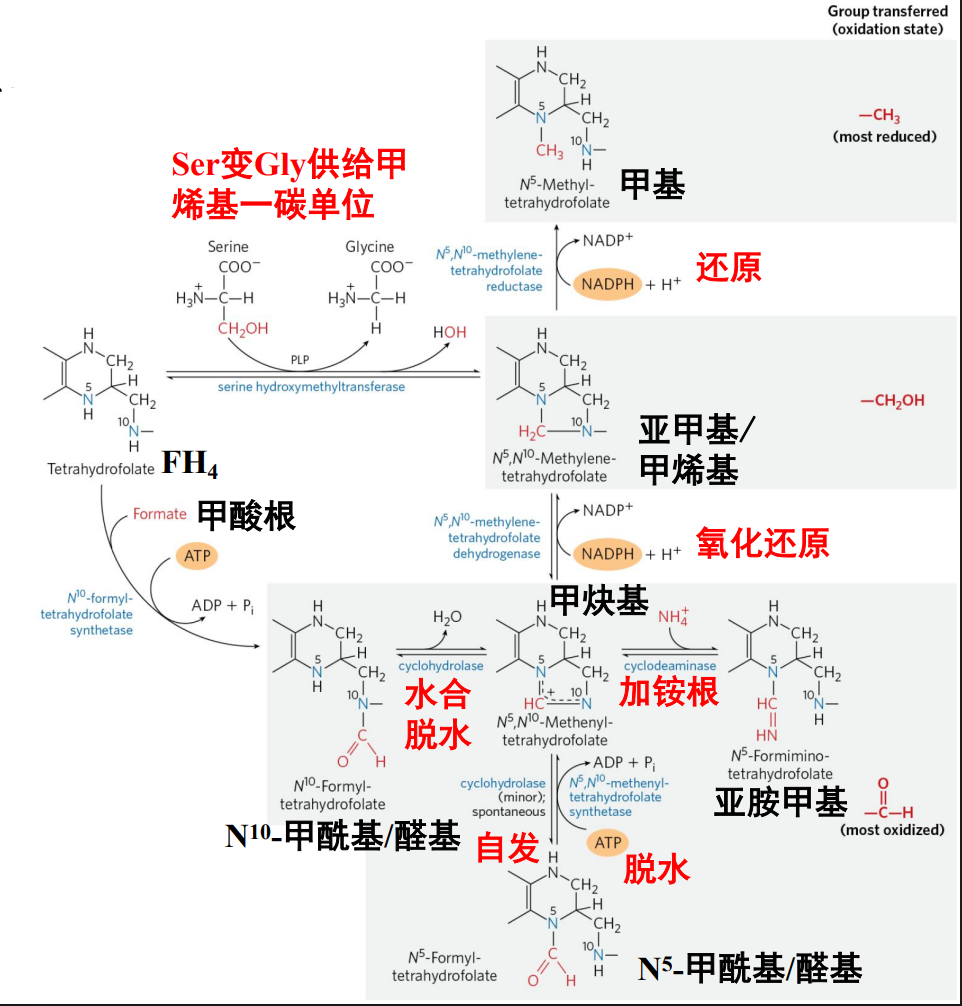
一碳单位
一碳单位 (one carbon unit),指的是含有一个碳原子的有机基团,所以\(\ce{CO2,\ HCO^{-}3}\)不属于一碳单位。
一碳单位不能游离存在,必须结合在一碳单位载体上。
氨基酸代谢中,一碳单位的贡献者主要包括丝氨酸、甘氨酸、组氨酸、色氨酸,苏氨酸也能有部分贡献。
一碳单位具有重要的生物学功能,包括:
- 参与嘌呤,嘧啶的合成
- 联系氨基酸与核苷酸的代谢
- 参与蛋白质的翻译后修饰(甲基化)
四氢叶酸
5,6,7,8-四氢叶酸 (\(\ce{FH4}\)) 又称活性叶酸,通过叶酸还原得到。
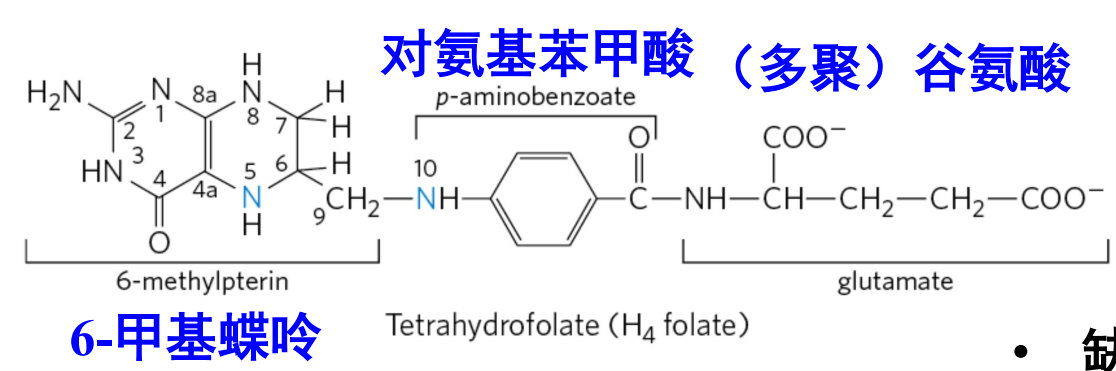
一碳单位通常结合在 \(\ce{FH4}\) 的 \(\ce{N^5, N^{10}}\) 上。
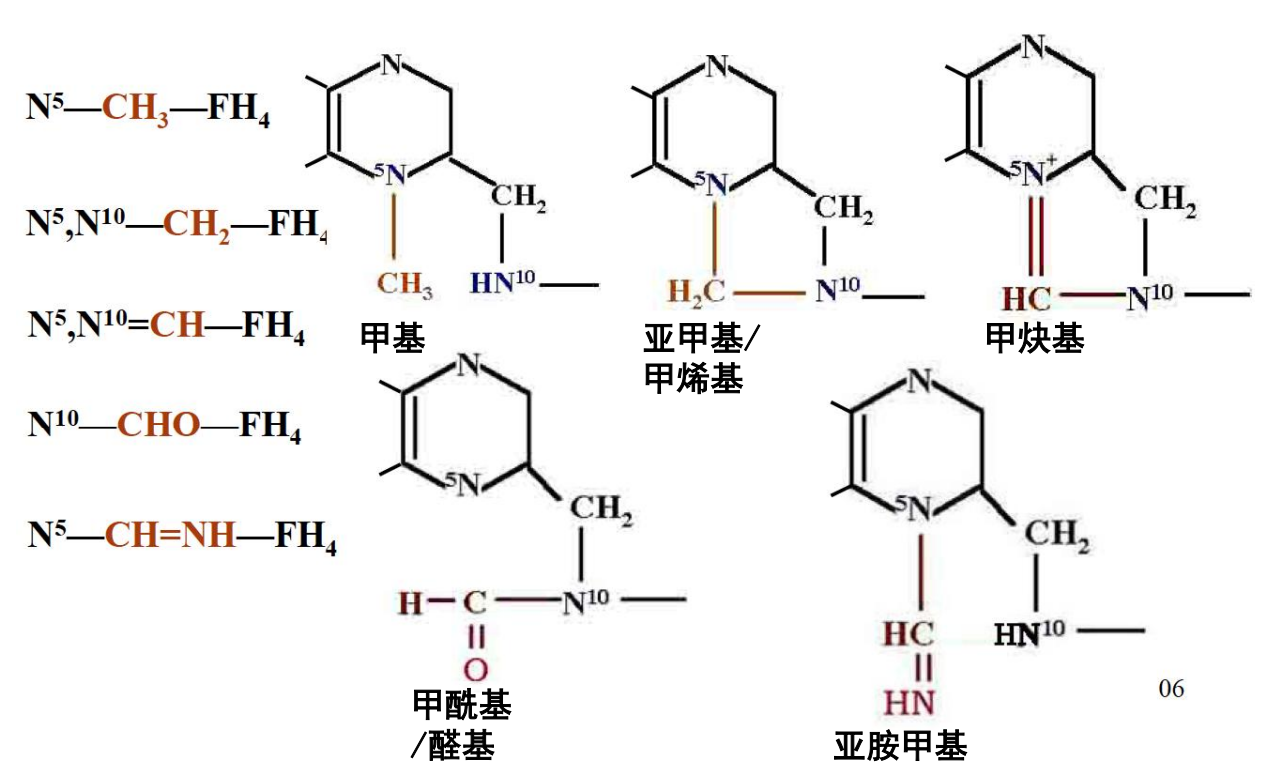
一般情况下,\(\ce{N^5}\)-甲基-四氢叶酸携带最还原态的一碳单位,而不同氧化态的一碳单位之间可以相互转化: