酶学 Enzymology
本章节要求如下:
掌握
酶的分子组成、酶的活性中心、同工酶、酶促反应特点、米氏方程、别构调节、化学修饰调节、酶原及其激活
酶主要有以下种类:
- 氧化还原酶(oxidoreductase):催化氧化还原反应,包括催化传递电子、氢以及需要氧气参加反应的酶
- 转移酶(transferase):催化底物之间基团转移或交换
- 水解酶(hydrolase):催化底物发生水解反应
- 裂合酶(lyase):催化从底物移去一个基团并形成双建的反应或其逆反应
- 异构酶(isomerase):催化分子内部基团的位置互换,几何或者光学异构体互变,以及醛酮互变
- 连接酶(ligase):催化两种底物形成一种产物并同时偶联高能键水解和能量释放
| 酶的分类 |
系统名称 |
编号 |
催化反应 |
推荐名称 |
| 1. 氧化还原酶类 |
L-乳酸 : NAD⁺-氧化还原酶 |
EC. 1. 1. 1. 27 |
L-乳酸 + NAD⁺ ⇌ 丙酮酸 + NADH + H⁺ |
L-乳酸脱氢酶 |
| 2. 转移酶类 |
L-丙氨酸 : α-酮戊二酸氨基转移酶 |
EC. 2. 6. 1. 2 |
L-丙氨酸 + α-酮戊二酸 ⇌ 丙酮酸 + L-谷氨酸 |
谷丙转氨酶 |
| 3. 水解酶类 |
1,4-α-D-葡聚糖-聚糖水解酶 |
EC. 3. 2. 1. 1 |
水解含有 3 个以上 1,4-α-D-葡萄糖基的多糖中 1,4-α-D-葡萄糖苷键 |
α-淀粉酶 |
| 4. 裂合酶类 |
D-果糖-1,6-二磷酸-D-甘油醛-3-磷酸裂合酶 |
EC. 4. 1. 2. 13 |
D-果糖-1,6-二磷酸 ⇌ 磷酸二羟丙酮 + D-甘油醛-3-磷酸 |
果糖二磷酸醛缩酶 |
| 5. 异构酶类 |
D-甘油醛-3-磷酸醛-酮异构酶 |
EC. 5. 3. 1. 1 |
D-甘油醛-3-磷酸 ⇌ 磷酸二羟丙酮 |
磷酸丙糖异构酶 |
| 6. 连接酶类 |
L-谷氨酸 : 氨连接酶(生成 ADP) |
EC. 6. 3. 1. 2 |
ATP + L-谷氨酸 + NH₃ → ADP + Pi + L-谷氨酰胺 |
谷氨酰胺合成酶 |
酶的分子结构与功能
活性中心
酶的活性中心是酶分子执行其催化功能的部位,能与底物特异结合,能催化底物转变为产物,具有特定三维结构,也被成为酶的活性部位。
与酶活性息息相关的基团被称为必需基团。
\[
必需基团 \begin{cases}
活性中心外的必需基团 \\
\\
活性中心内的必需基团 \begin{cases}
结合集团 \\
\\
催化集团
\end{cases}
\end{cases}
\]
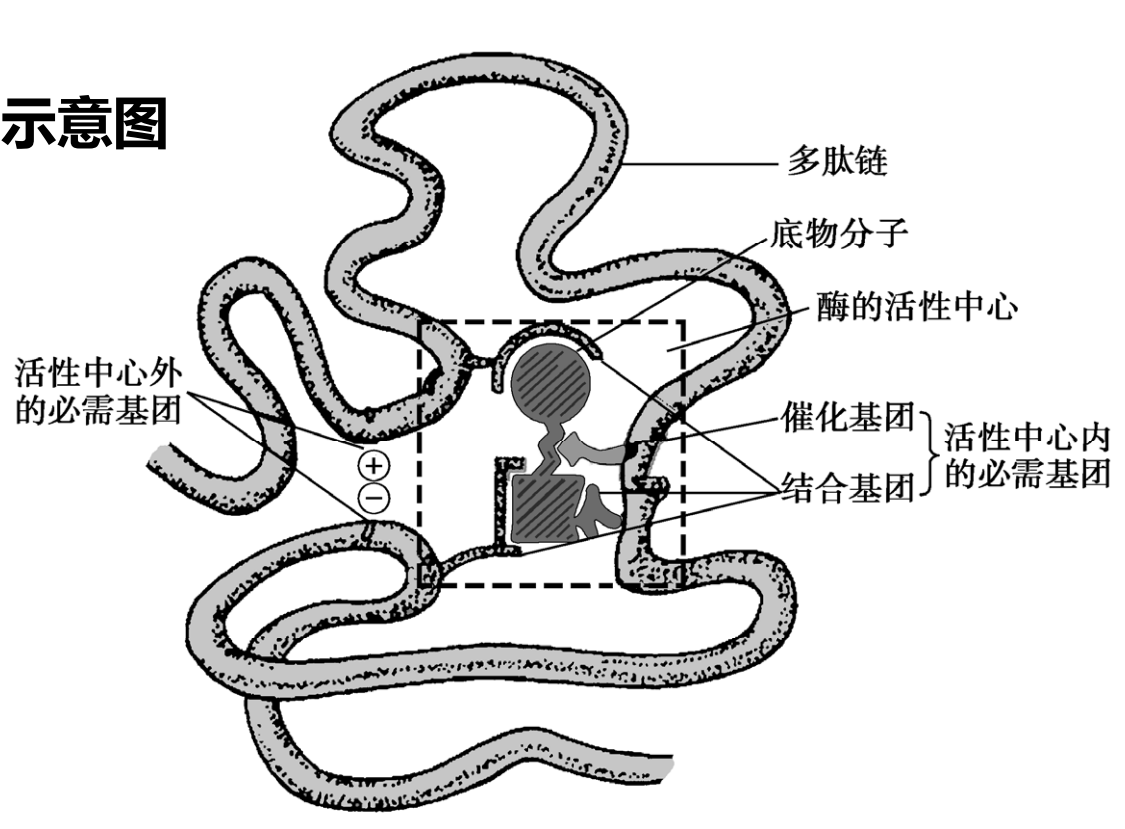
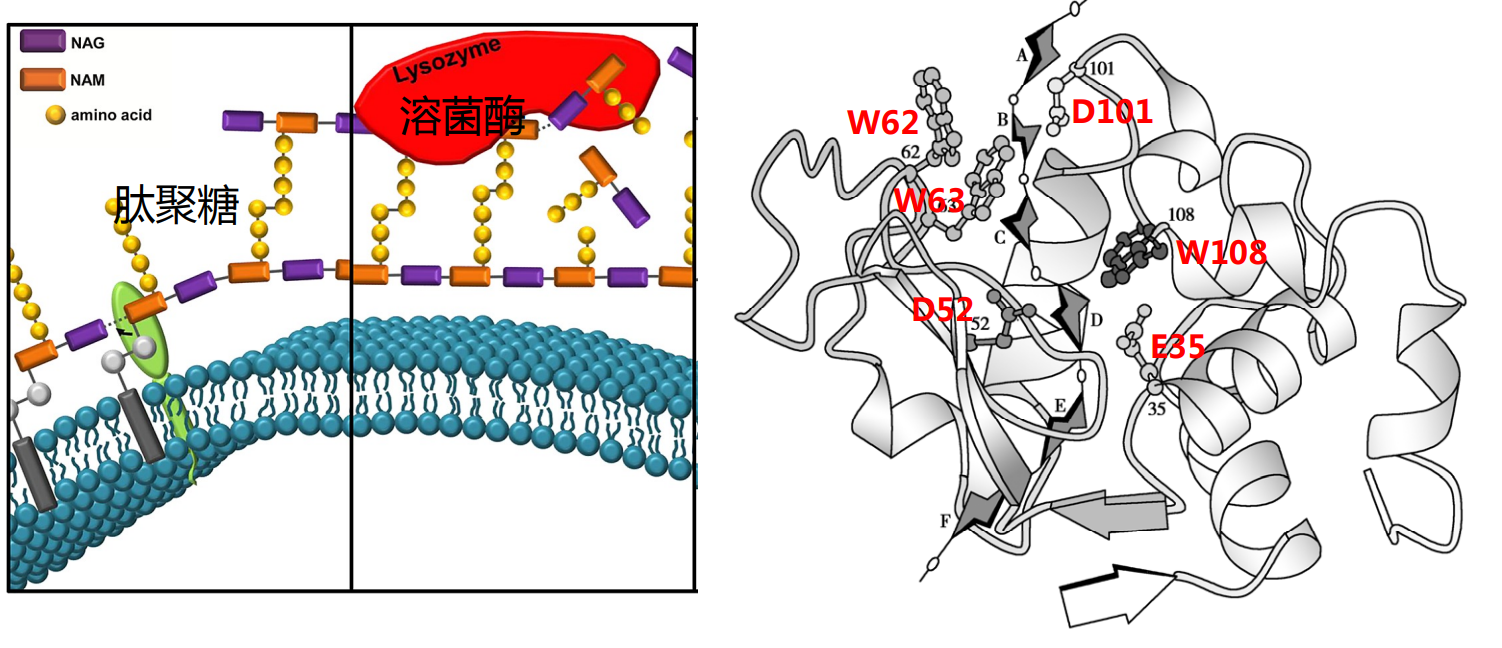
溶菌酶活性中心
酶的分子组成中常含有辅助因子,以下是酶从组成上的分类。
\[
酶 \begin{cases}
单纯酶 \\
\\
缀合酶/全酶 \begin{cases}
酶蛋白 \\
\\
辅因子 \begin{cases}
辅酶 \\
\\
辅基
\end{cases}
\end{cases}
\end{cases}
\]
下表展示了常见的辅酶/辅基作用。
| 辅酶或辅基 |
缩写 |
转移的基团 |
所含的维生素 |
| 烟酰胺腺嘌呤二核苷酸,辅酶Ⅰ |
NAD⁺ |
氢原子、电子 |
烟酰胺(维生素 PP)B₃ |
| 烟酰胺腺嘌呤二核苷酸磷酸,辅酶Ⅱ |
NADP⁺ |
氢原子、电子 |
烟酰胺(维生素 PP)B₃ |
| 黄素单核苷酸 |
FMN |
氢原子 |
维生素 B₂ |
| 黄素腺嘌呤二核苷酸 |
FAD |
氢原子 |
维生素 B₂ |
| 焦磷酸硫胺素 |
TPP |
醛基 |
维生素 B₁ |
| 磷酸吡哆醛 |
|
氨基 |
维生素 B₆ |
| 辅酶 A |
CoA |
酰基 |
泛酸(维生素 B₅) |
| 生物素 |
|
二氧化碳 |
生物素(维生素 B₇) |
| 四氢叶酸 |
FH₄ |
一碳单位 |
叶酸(维生素 B₉) |
| 甲基钴胺素 |
|
甲基 |
维生素 B₁₂ |
| 5'-脱氧腺苷钴胺素 |
|
相邻碳原子上氢原子、烷基、羧基的互换 |
维生素 B₁₂ |
金属离子是最常见的辅因子,以金属离子作为辅因子的酶分为金属酶(metalloenzyme)和金属激活酶(metal activated enzyme)。
| 金属酶 |
金属离子 |
金属激活酶 |
金属离子 |
| 过氧化氢酶 |
Fe²⁺ |
丙酮酸激酶 |
K⁺、Mg²⁺ |
| 过氧化物酶 |
Fe²⁺ |
丙酮酸羧化酶 |
Mn²⁺、Zn²⁺ |
| β-内酰胺酶 |
Zn²⁺ |
蛋白激酶 |
Mg²⁺、Mn²⁺ |
| 固氮酶 |
Mo²⁺ |
精氨酸酶 |
Mn²⁺ |
| 核糖核苷酸还原酶 |
Mn²⁺ |
磷脂酶 C |
Ca²⁺ |
| 羧基肽酶 |
Zn²⁺ |
细胞色素氧化酶 |
Cu²⁺ |
| 超氧化物歧化酶 |
Cu²⁺、Zn²⁺、Mn³⁺ |
己糖激酶 |
Mg²⁺ |
| 碳酸酐酶 |
Zn²⁺ |
脲酶 |
Ni²⁺ |
同工酶
同工酶( isoenzyme 或isozyme) 是指催化相同的化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。
比如动物的乳酸脱氢酶就有五种同工酶:
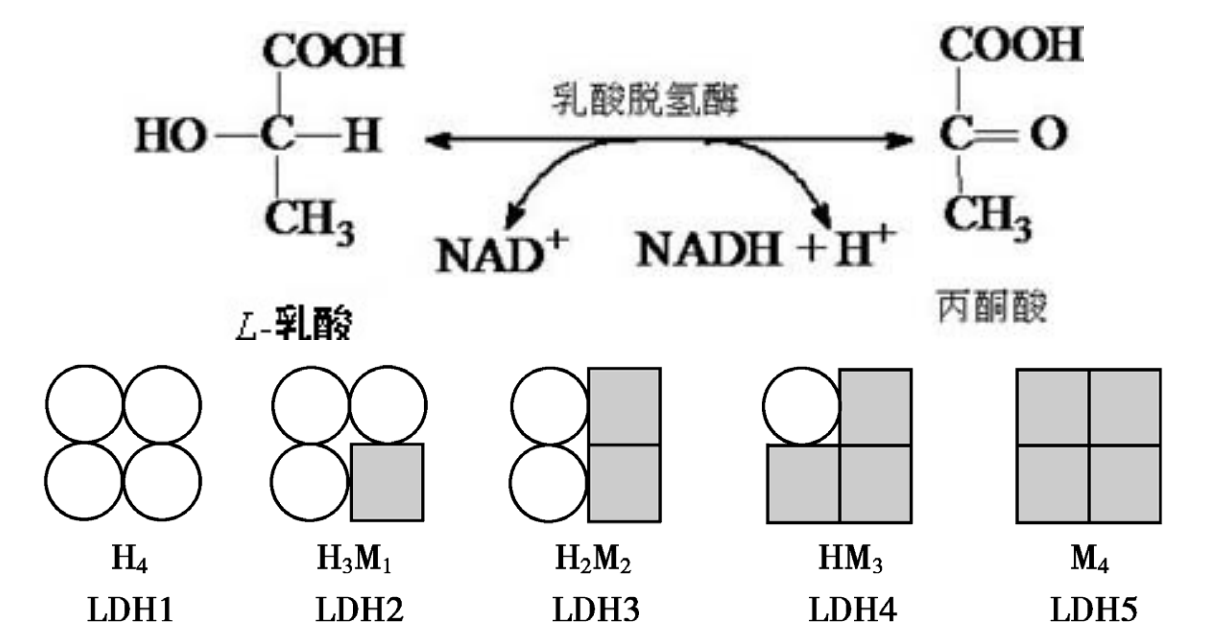
同一个体不同发育阶段和不同组织器官中,编码不同亚基的基因开放程度不同,合成的亚基种类和数量也不同,这使得某种同工酶在同一个体的不同组织,以及同一细胞的不同亚细胞结构的分布也不同,形成不同的同工酶谱。
电泳下同工酶谱内不同同工酶之间可以被区分开来:
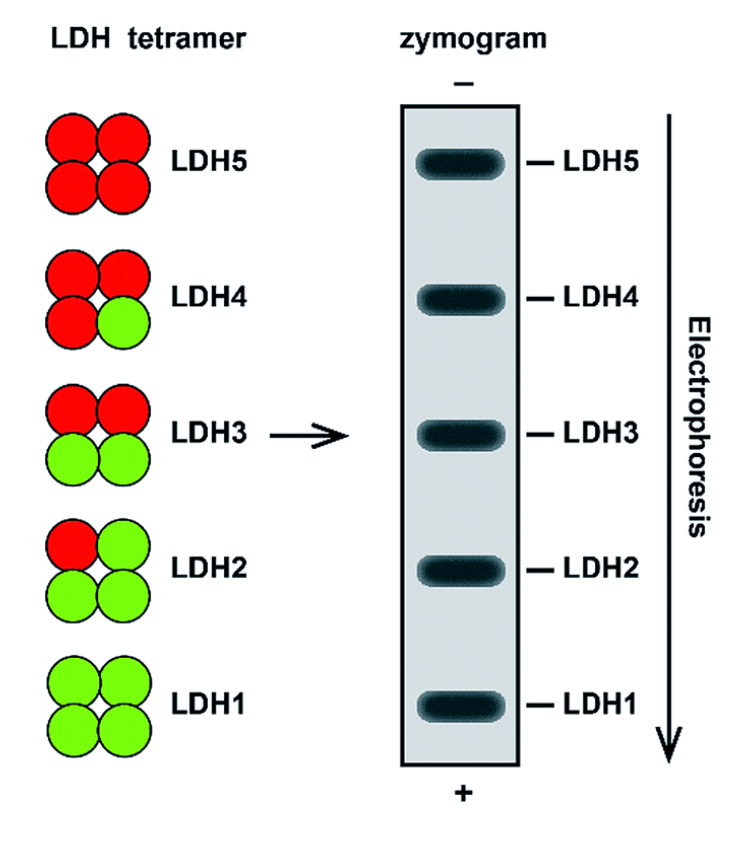
LDH
同工酶 |
红细胞 |
白细胞 |
血清 |
骨骼肌 |
心肌 |
肺 |
肾 |
肝 |
脾 |
| LDH1 |
43 |
12 |
27 |
0 |
73 |
14 |
43 |
2 |
10 |
| LDH2 |
44 |
49 |
34.7 |
0 |
24 |
34 |
44 |
4 |
25 |
| LDH3 |
12 |
33 |
20.9 |
5 |
3 |
35 |
12 |
11 |
40 |
| LDH4 |
1 |
6 |
11.7 |
16 |
0 |
5 |
1 |
27 |
20 |
| LDH5 |
0 |
0 |
5.7 |
79 |
0 |
12 |
0 |
56 |
5 |
酶的工作原理
酶具有极高的催化效率
酶与一般催化剂催化效率往往能有数个数量级的差异。
| 化学反应 |
催化剂 |
反应温度(℃) |
速率常数 |
| 酰胺水解 |
H⁺ |
52 |
2.4×10⁻⁶ |
| 酰胺水解 |
OH⁻ |
53 |
8.5×10⁻⁶ |
| 酰胺水解 |
α-胰凝乳蛋白酶 |
25 |
14.9 |
| 尿素水解 |
H⁺ |
62 |
7.4×10⁻⁷ |
| 尿素水解 |
脲酶 |
21 |
5.0×10⁶ |
| 过氧化氢分解 |
Fe²⁺ |
56 |
22 |
| 过氧化氢分解 |
过氧化氢酶 |
22 |
4×10⁷ |
酶对底物具有高度的特异性
一种酶仅作用于一种或一类化合物,催化一定的化学反应并产生一定的产物,这种特性被称为酶的特异性或者专一性。
有的酶只作用于特定结构的底物分子,进行一种专一的反应,生成一种特定结构的产物,这种被称为绝对特异性。
相对的,有些酶可以作用于含有相同化学键或化学基团的一类化合物,这被称为相对特异性。
酶特异性的例子
- 乳酸脱氢酶对乳酸立体异构体的选择性催化:
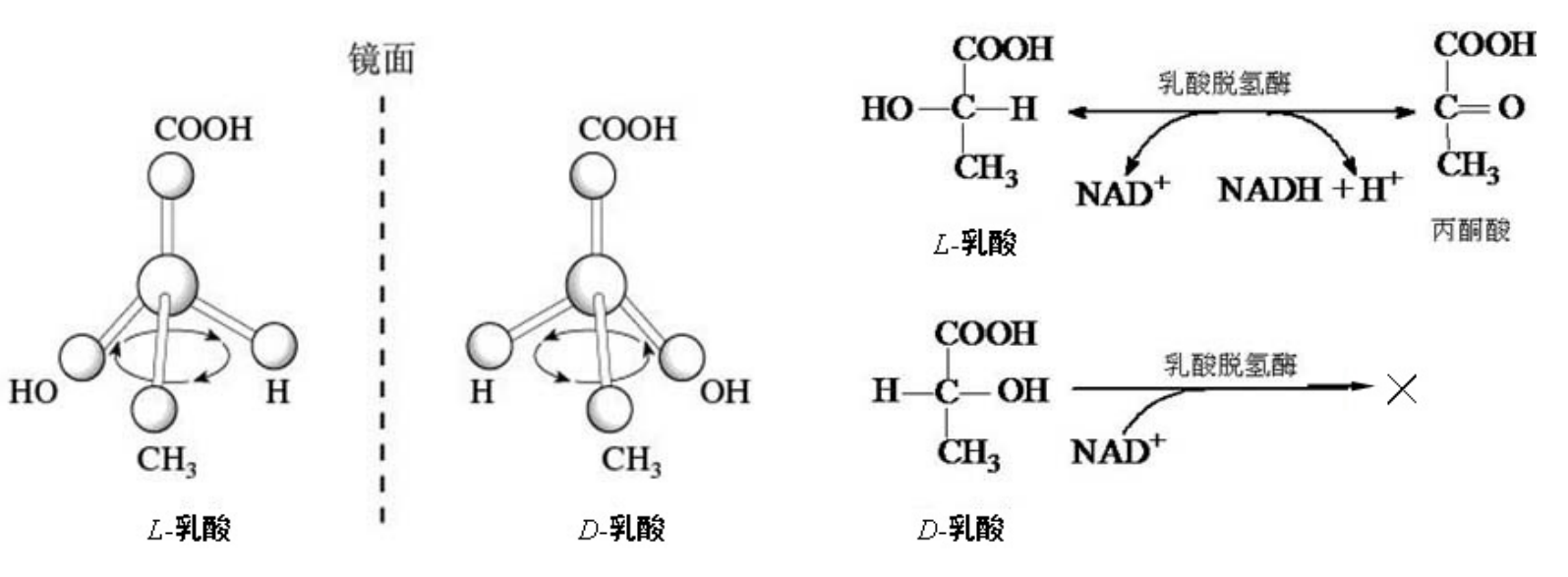
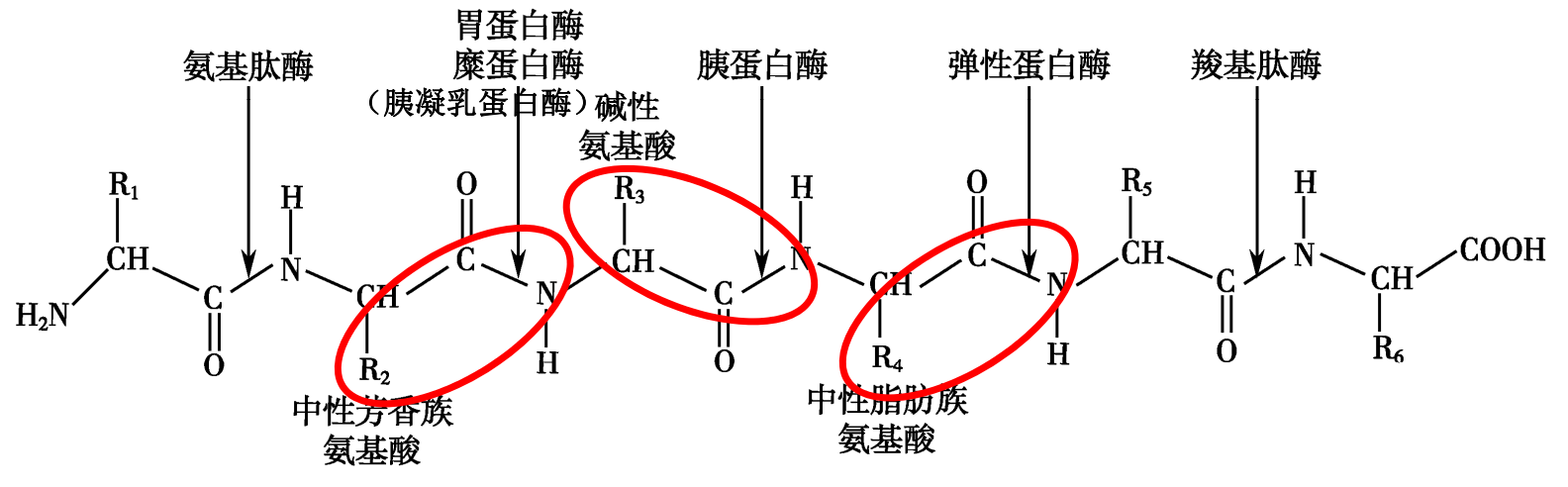
- 各种蛋白酶对肽键的专一性:
酶通过促进底物形成过渡态而提高反应速率
在阐述原理之前,先假定一个一元反应模型:
\[
\begin{aligned}
&S \rightleftharpoons P \\
&K'_{eq} = \frac{[P]}{[S]} \\
&\Delta G'\degree = -RT\ln{K'_{eq}} \\
&其中R=8.315J/mol\cdot K,\ T = 298K
\end{aligned}
\]
标准自由能变化每减小5.7 kJ/mol, 反应平衡常数增加10倍。
在所有化学反应中,都会涉及到过渡态——反应物转变成产物过程中能量最高的状态,与活化能\(\Delta G^\ddagger\)——反应物和过渡态能量的差值。
还是一元反应模型:
\[
\begin{aligned}
&S \rightarrow P \\
&V = k[S] \\
&k = \frac{k_BT}{h}e^{-\Delta G^\ddagger/RT} \\
&其中k_B为玻尔兹曼常数,h为普朗克常数
\end{aligned}
\]
活化能每减小5.7 kJ/mol, 速率常数增加10倍.
酶通过促进底物形成过渡态,而提高反应速率,酶通过稳定过渡态的结构,从而降低活化能。
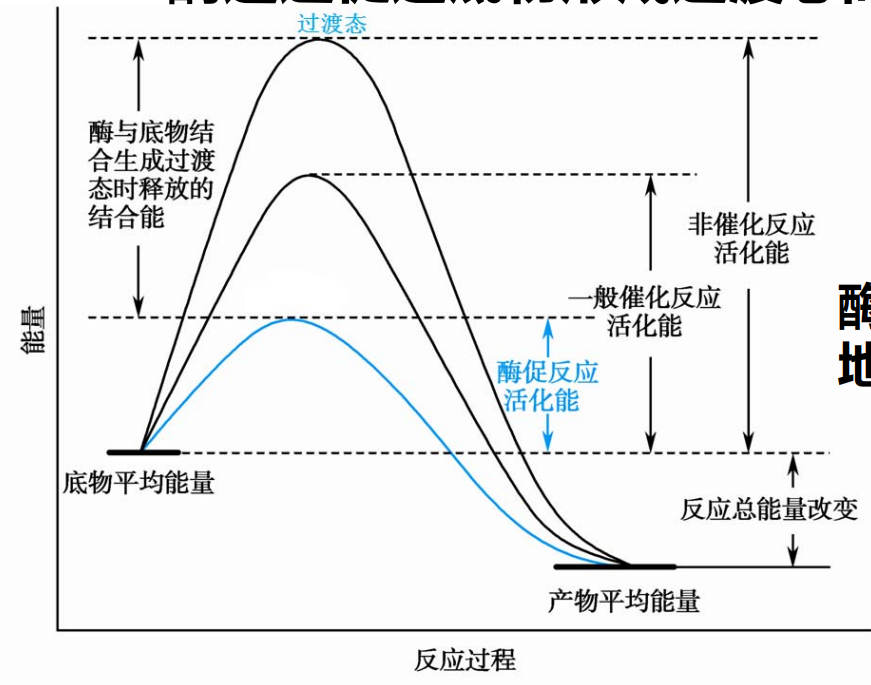
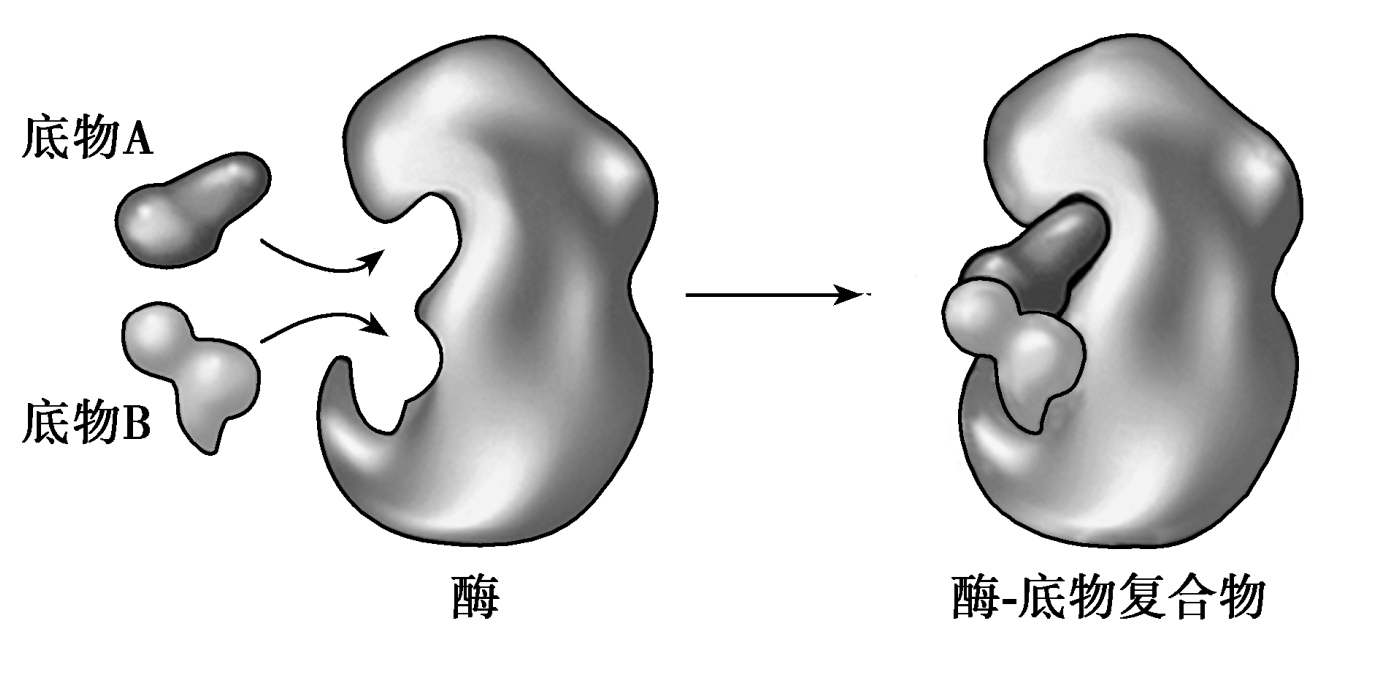
早期提出锁钥模型来解释,但是这个模型忽视了酶的结构是动态的,诱导契合理论更符合实际。
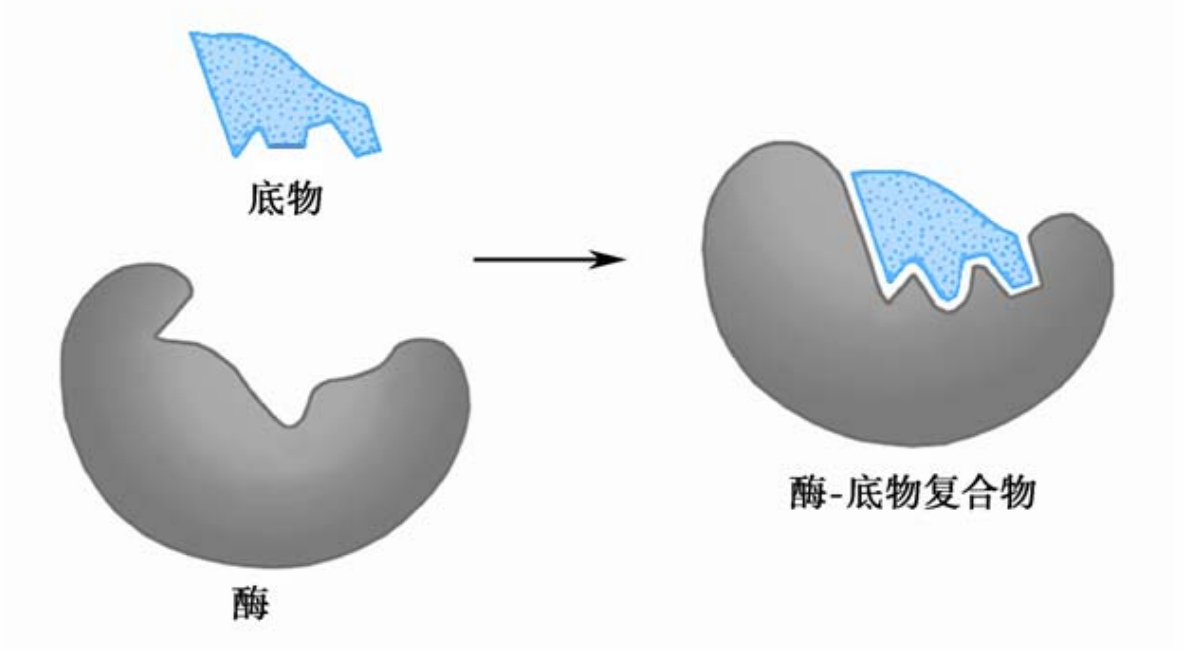
这样更能解释酶是如何利用结合能来降低反应的降低活化能的。(氢键,离子键和疏水作用)
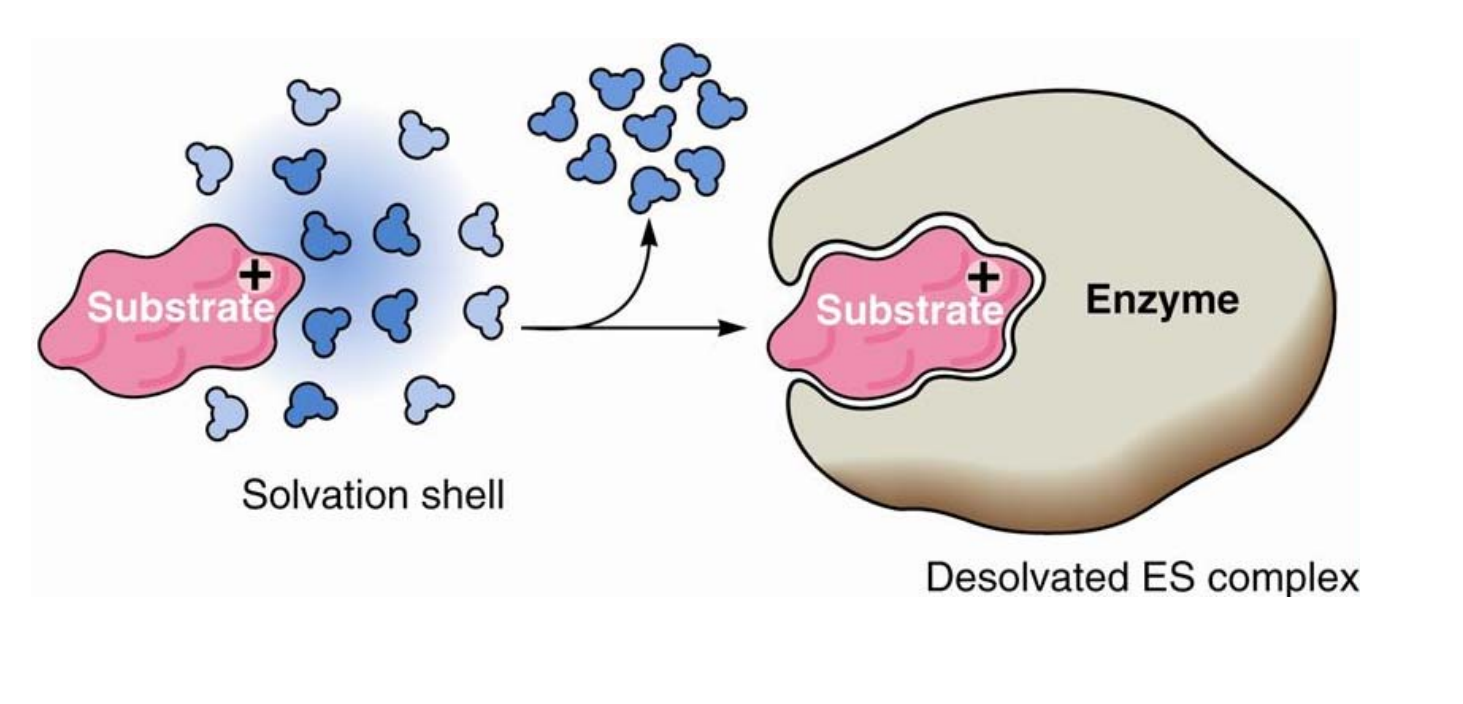
酶可以通过表面效应使底物分子去溶剂化,通过临近效应和定向排列促使底物以正确的方式与酶结合,以上三种效应富集了底物浓度,促进关键基团反应,排除了溶剂干扰,大大提升了反应速率。
酶催化机制
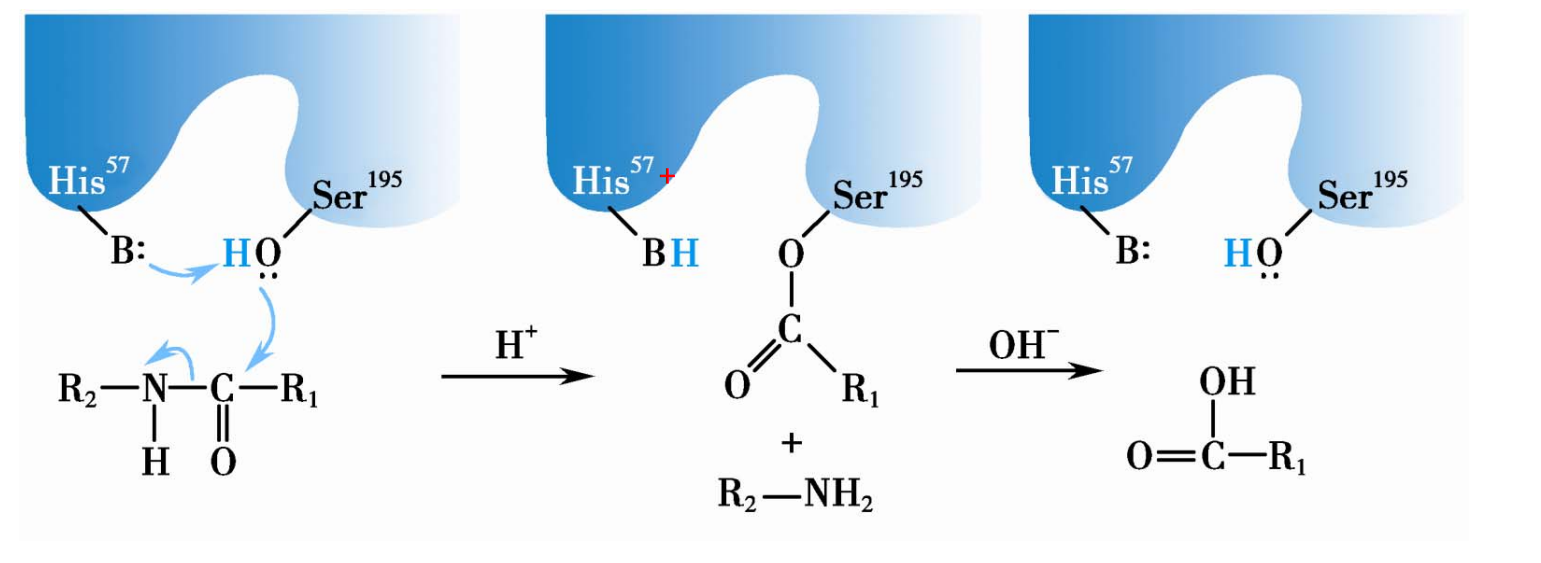
共价催化
例如胰凝乳蛋白酶就采用共价催化——活性中心基团与反应底物短暂形成共价键。
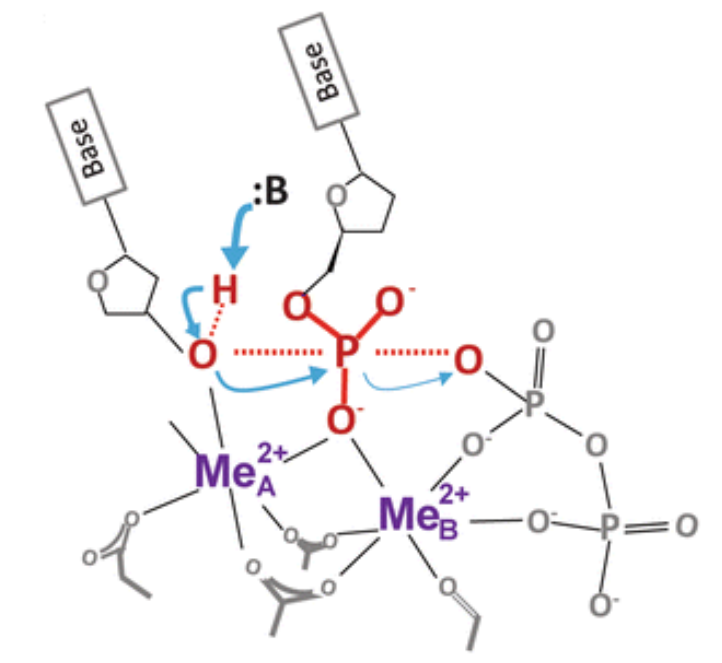
金属离子催化
酶在活性中心使用金属离子来协助底物结合、激活官能团(作为活性中心的一部分)、或稳定过渡态(中和静电荷,稳定酶的构象),比如DNA聚合酶的双金属离子催化机制。
酶促反应动力学
典型的米氏酶中,底物浓度对酶促反应速率的影响呈矩形双曲线。
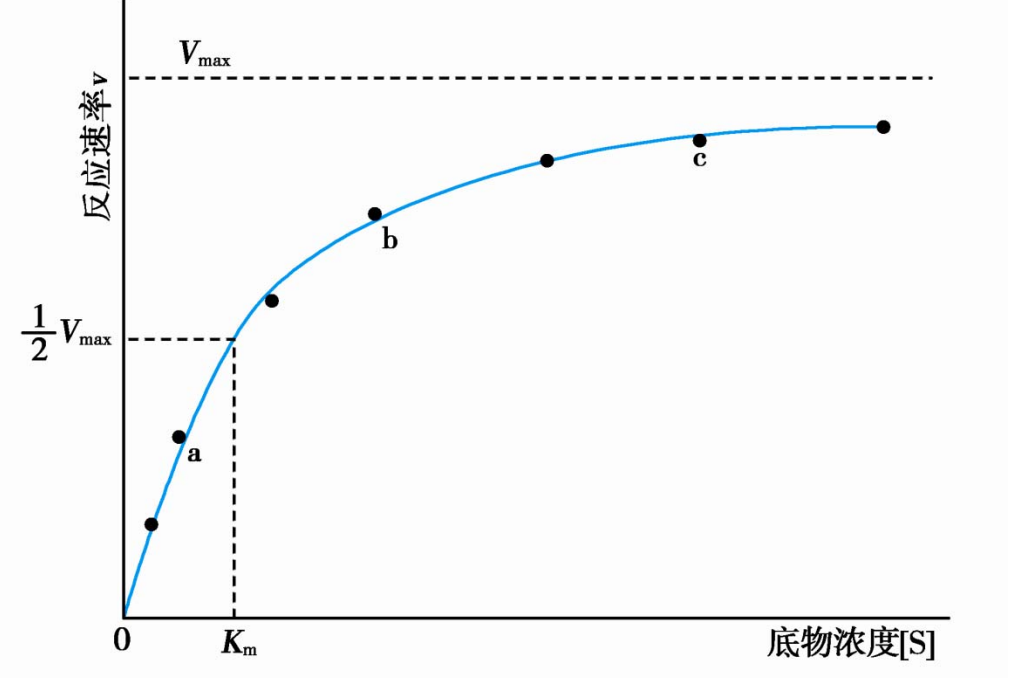
米氏酶遵循米氏酶动力学方程(米-曼方程),其基于几个前提假设:
- 单底物反应
- 反应体系处于稳态
- 测定的反应速率为初速率
- 底物总量远大于酶总量
- 底物总量约等于游离底物量
米-曼方程推导
米-曼方程推导如下:
$$
\begin{aligned}
&假设有二元反应,E为酶,S为底物 \
&E + S \ \overset{k_1}{\underset{k_2}{\rightleftharpoons}}\ ES \overset{k_3}{\rightarrow} E + P \
&当k_1>>k_2时,\
&k_1([Et]-[ES])[S] = k_2[ES] + k_3[ES] \
&\frac{([Et]-[ES])[S]}{[ES]} = \frac{k_2+k_3}{k_1} \
&令 K_m = \frac{k_2+k_3}{k_1} \
&[ES] = \frac{[Et][S]}{K_m+[S]} \
&v = k_3[ES] = \frac{k_3[Et][S]}{k_m + [S]} \
&\because V_{max} = k_3[Et] \
&v = \frac{V_{max}[S]}{K_m + [S]}
\end{aligned}
$$
由上推导,当\([S]<<K_m\)时候(酶未饱和,底物稀少),\(v\propto [S]\)。
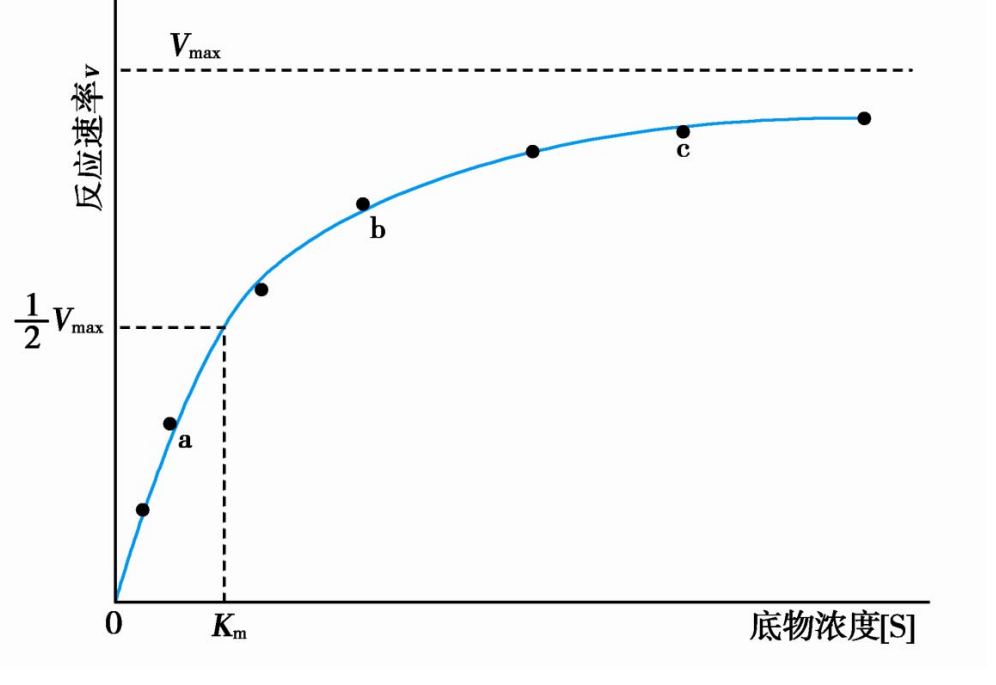
\(K_m\)值等于酶促反应速率为最大反应速率一半时的底物浓度,即\([S] = K_m,\ v=V_{max}/2\)
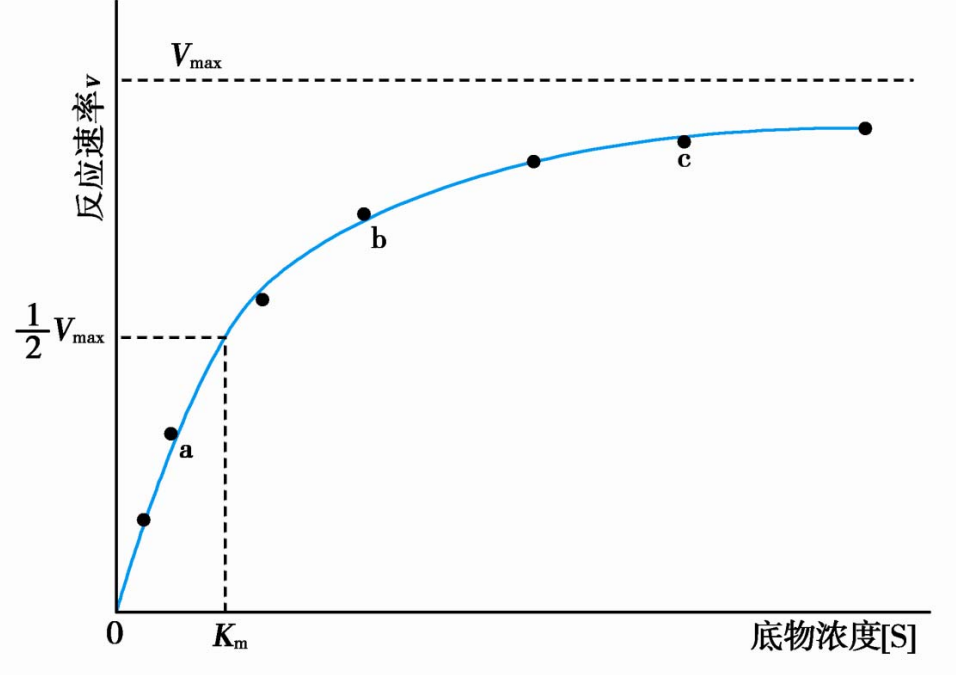
\(V_{max}\)是酶被底物饱和时的反应速率,即\([S]>>K_m\)。
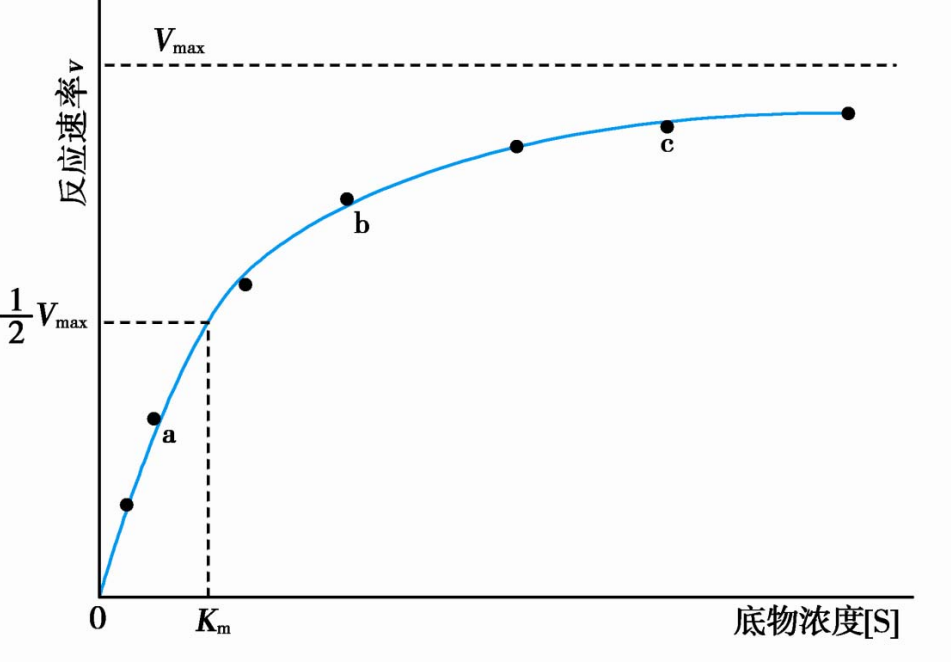
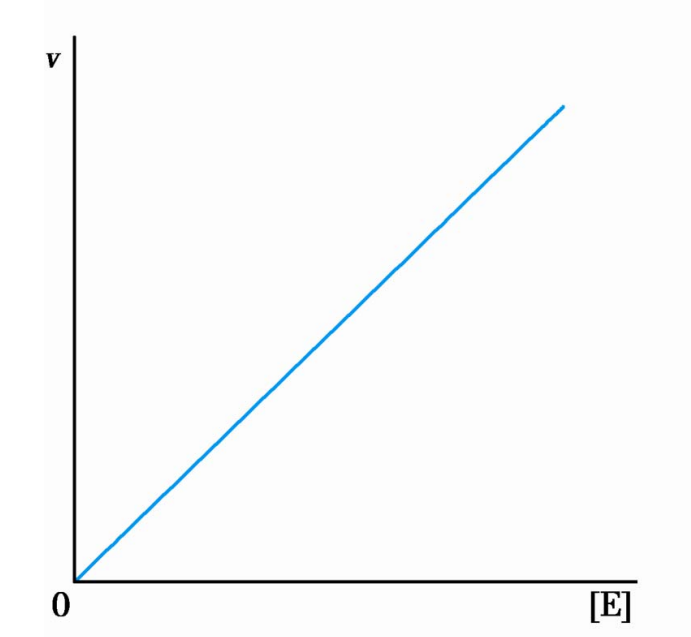
同时,底物饱和时酶浓度对酶促反应速率的影响呈直线关系。
在一定条件下(\(k_3<<k_2\)),\(K_m\)可以表示酶对底物的亲和力,即\(K_m = k_2/k_1 = K_d\)。
\(K_m\)是酶的特征常数,通常和细胞里底物的浓度处于同一数量级。
| 酶 |
底物 |
Km (mol/L) |
| 己糖激酶(脑) |
ATP |
4×10⁻⁴ |
|
D-葡萄糖 |
5×10⁻⁵ |
|
D-果糖 |
1.5×10⁻³ |
| 碳酸酐酶 |
HCO3- |
2.6×10⁻² |
| 胰凝乳蛋白酶 |
甘氨酰酪氨酰甘氨酸 |
1.08×10⁻¹ |
|
N-苯甲酰酪氨酰胺 |
2.5×10⁻³ |
| β-半乳糖苷酶 |
D-乳糖 |
4.0×10⁻³ |
| 过氧化氢酶 |
H2O2 |
2.5×10⁻² |
| 溶菌酶 |
N-乙酰氨基葡萄糖 |
6.0×10⁻³ |
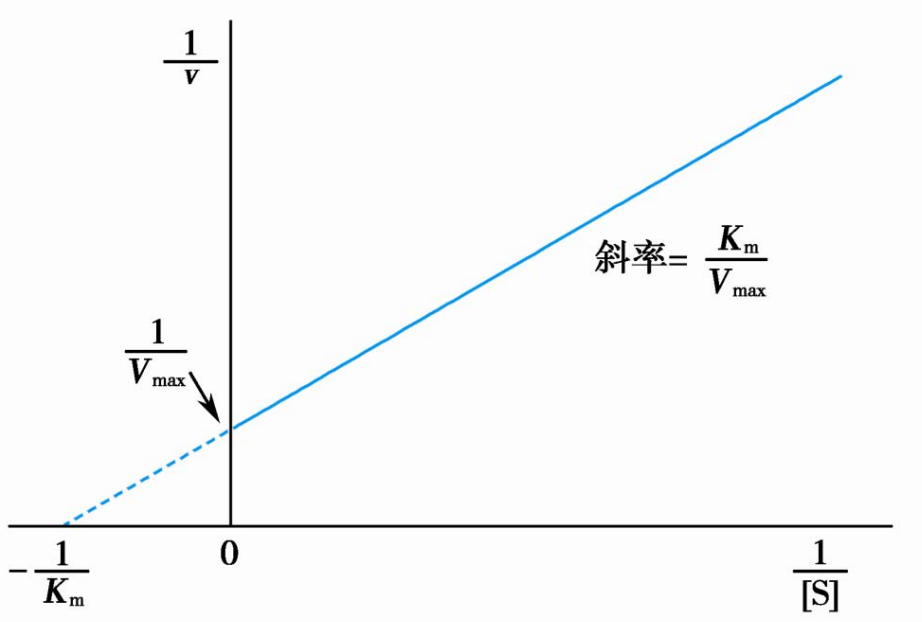
当然,从米-曼方程的曲线图里求\(V_{max}\)与\(K_m\)还是太吃操作了,有没有更简单的求法?
有的兄弟有的,通过对米-曼方程两侧求倒数,我们就得到了线性方程,通过这个方程作图求取\(V_{max}\)与\(K_m\)的方法称为林-贝作图法。
\[
\frac{1}{v} = \frac{K_m}{V_{max}}\cdot\frac{1}{[S]}+\frac{1}{V_{max}}
\]
当酶被底物饱和时,单位时间内每个酶分子(或活性中心)催化底物转变成产物的分子数称为酶的转换数\(k_{cat}\)(turnover number),即\(k_3\)。
| 酶 |
转换数 [s⁻¹] * |
酶 |
转换数 [s⁻¹] * |
| 碳酸酐酶 |
600 000 |
(肌肉)乳酸脱氢酶 |
200 |
| 过氧化氢酶 |
80 000 |
胰凝乳蛋白酶 |
100 |
| 乙酰胆碱酯酶 |
25 000 |
醛缩酶 |
11 |
| 磷酸丙糖异构酶 |
4400 |
溶菌酶 |
0.5 |
| α-淀粉酶 |
300 |
果糖-2,6-二磷酸酶 |
0.1 |
*转换数是在酶被底物饱和的状态下测定的,受温度和pH等因素的影响。
如果我们将\(K_m\)(酶对底物的亲和度)和\(k_{cat}\)(酶对底物的催化效率),就能得到酶的专一性常数\({k_{cat}/K_m}\)。
| Enzyme |
Substrate |
kcat (s−1) |
Km (M) |
kcat/Km (M−1s−1) |
| Acetylcholinesterase |
Acetylcholine |
1.4 × 10⁴ |
9 × 10⁻⁵ |
1.6 × 10⁸ |
| Carbonic anhydrase |
CO2 |
1 × 10⁶ |
1.2 × 10⁻² |
8.3 × 10⁷ |
|
HCO3− |
4 × 10⁵ |
2.6 × 10⁻² |
1.5 × 10⁷ |
| Catalase |
H2O2 |
4 × 10⁷ |
1.1 × 10⁰ |
4 × 10⁷ |
| Crotonase |
Crotonyl-CoA |
5.7 × 10³ |
2 × 10⁻⁵ |
2.8 × 10⁸ |
| Fumarase |
Fumarate |
8 × 10² |
5 × 10⁻⁶ |
1.6 × 10⁸ |
|
Malate |
9 × 10² |
2.5 × 10⁻⁵ |
3.6 × 10⁷ |
| β-Lactamase |
Benzylpenicillin |
2.0 × 10³ |
2 × 10⁻⁵ |
1 × 10⁸ |
温度对酶促反应速率的影响具有双重性
对于酶来说,在最适温度上酶促反应效率最高,过高或者过低都会使速率减慢。
pH可以改变酶与底物的解离状态
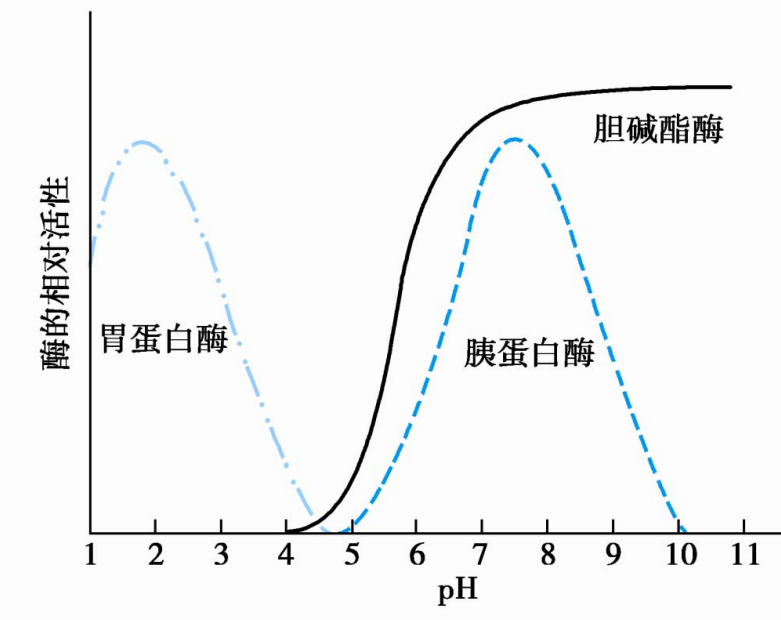
pH可以改变酶与底物的解离状态,从而影响酶促反应速率。酶催化活性最高时反应体系的pH称为酶的最适pH(optimum pH)。
抑制剂可降低酶促反应速率
凡能使酶活性下降而不引起酶蛋白变性的物质统称为酶的抑制剂(inhibitor),具体分为:
- 不可逆性抑制:和酶活性中心的必需基团共价结合,不能用透析、超滤等方法予以去除。包括有机磷化合物,砷化合物等。
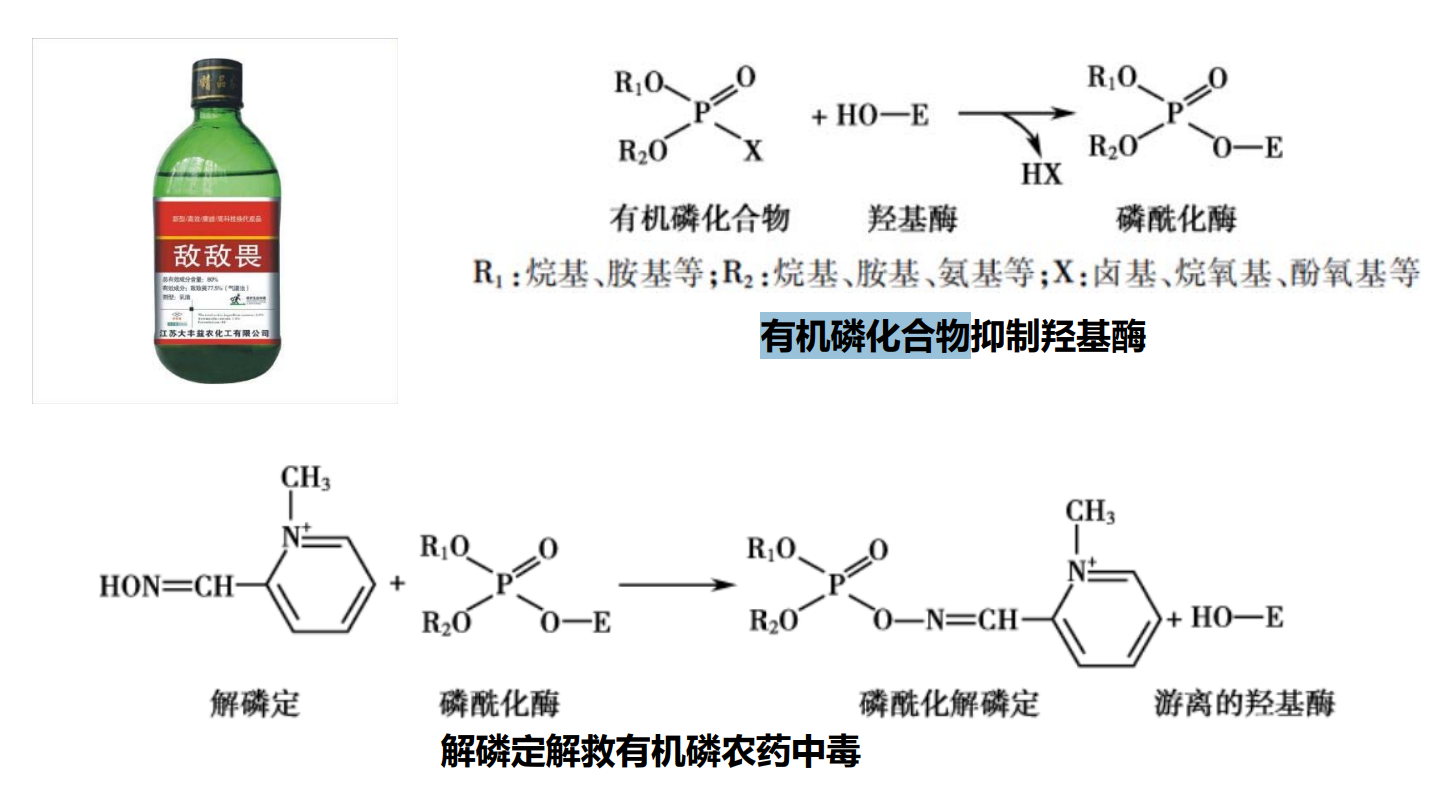
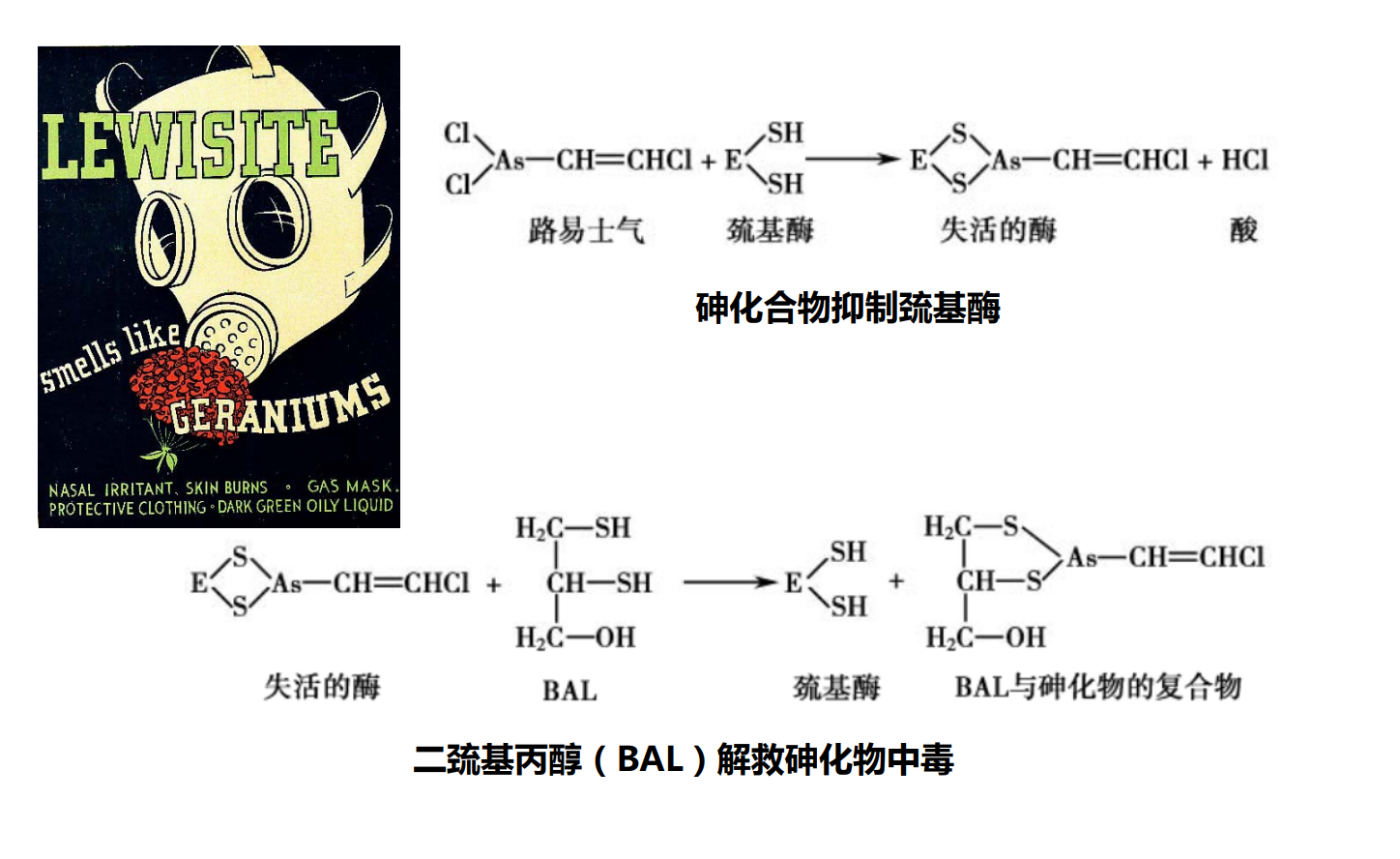
- 可逆性抑制剂:和酶非共价结合,使酶活性降低或消失,采用透析超滤或稀释等物理方法可将抑制剂除去,使酶的活性恢复。
可逆性抑制剂又分为:
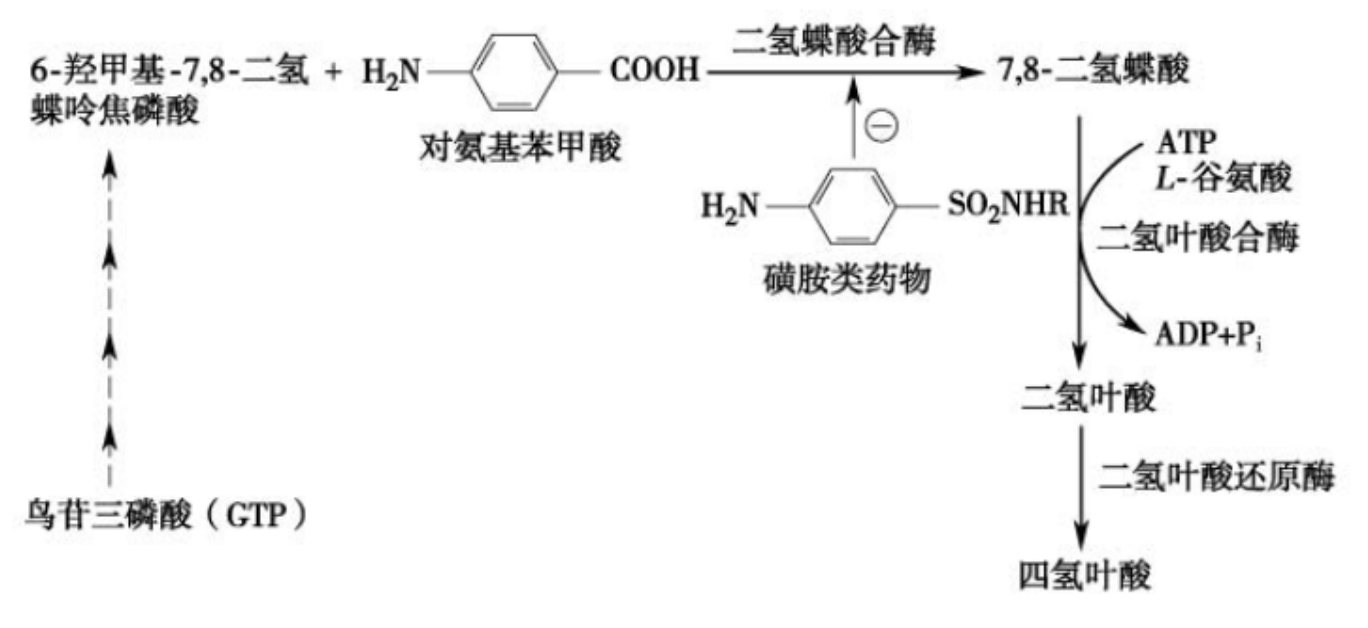
- 竞争性抑制剂:抑制剂和酶的底物在结构上相似,可与底物竞争结合酶的活性中心,从而阻碍酶与底物形成中间产物,这种作用称为竞争性抑制。比如磺胺类药物是二氢蝶酸合酶的竞争性抑制剂。
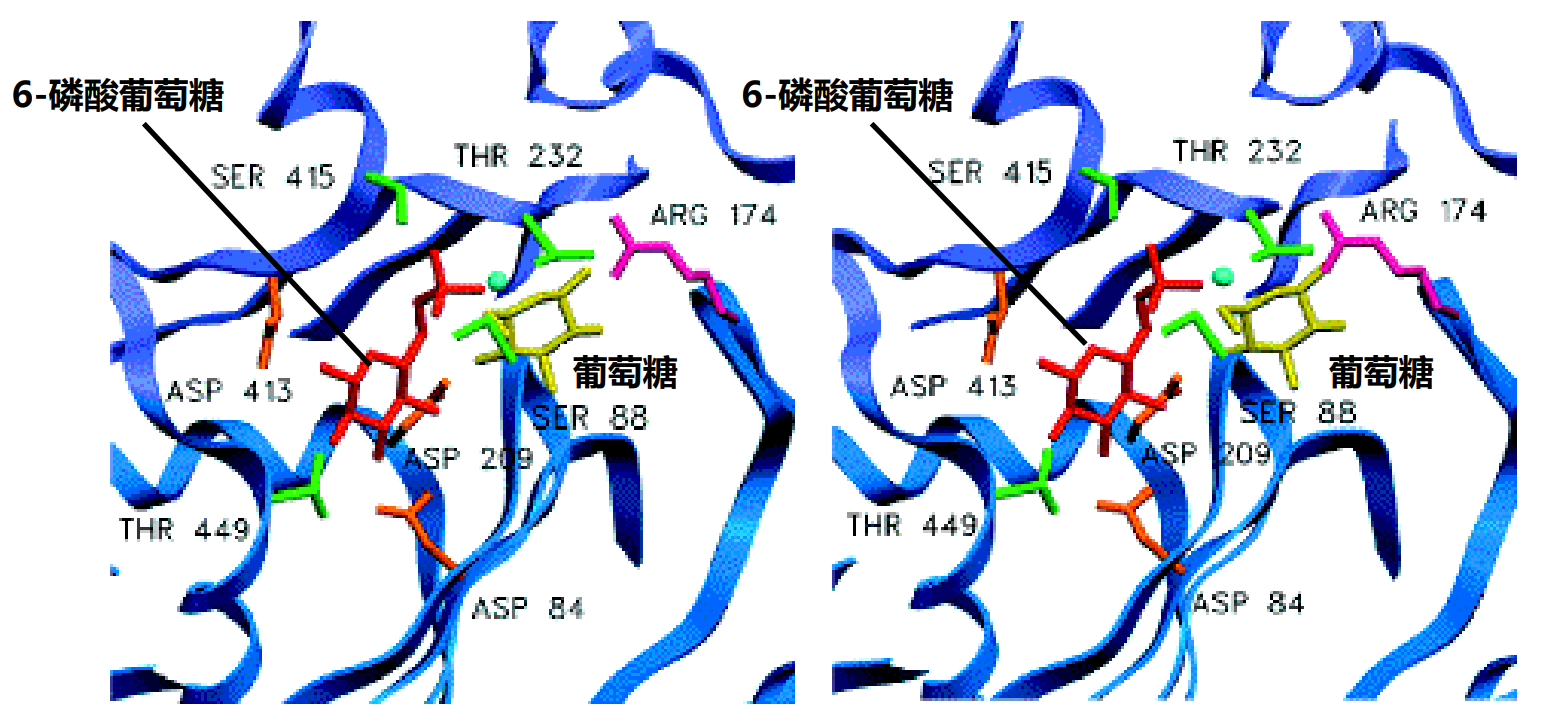
- 非竞争性抑制剂:抑制剂和酶活性中心以外的结合位点相结合,不影响酶与底物的结合,底物也不影响酶与抑制剂的结合,但是抑制剂-酶-底物复合物没有催化活性,这种抑制作用称为非竞争性抑制。比如6-磷酸葡萄糖非竞争性抑制己糖激酶(糖酵解调控)。
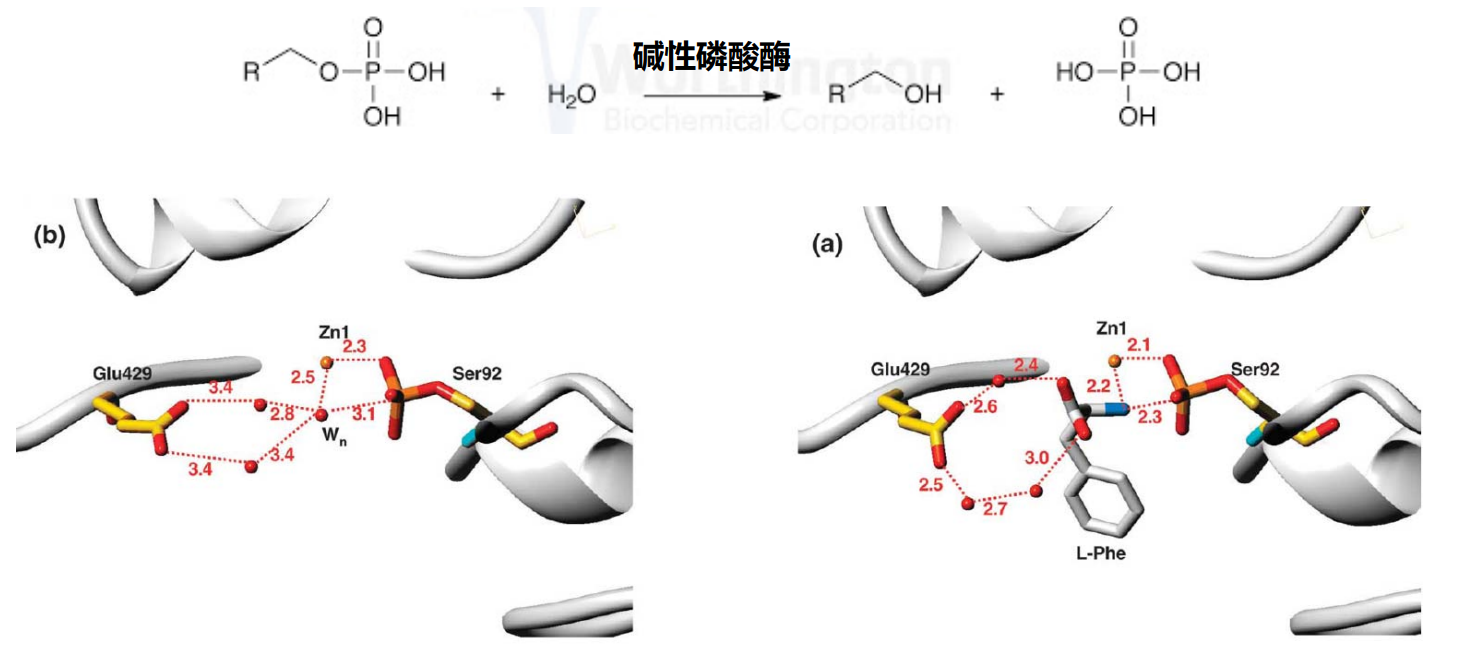
- 反竞争性抑制剂:抑制剂和酶活性中心以外的结合位点相结合,抑制剂只和酶-底物复合物结合,使中间产物ES的量下降,这种抑制作用称为反竞争性抑制。比如苯丙氨酸反竞争性抑制碱性磷酸酶。
以下是三种可逆性抑制作用比较:
| 作用特点 |
无抑制剂 |
竞争性抑制剂 |
非竞争性抑制剂 |
反竞争性抑制剂 |
| I 的结合部位 |
|
E |
E、ES |
ES |
| 动力学特点 |
|
|
|
|
| 表观 Km |
Km |
增大 |
不变 |
减小 |
| Vmax |
Vmax |
不变 |
降低 |
降低 |
| 双倒数作图 |
|
|
|
|
| 横轴截距 |
−1/Km |
增大 |
不变 |
减小 |
| 纵轴截距 |
1/Vmax |
不变 |
增大 |
增大 |
| 斜率 |
Km/Vmax |
增大 |
增大 |
不变 |
竞争性抑制
关于竞争性抑制对米-曼方程的影响推导如下:
\[
\begin{aligned}
&假设有额外反应,I为竞争性抑制剂 \\
&E + S \ \overset{k_1}{\underset{k_2}{\rightleftharpoons}}\ ES \overset{k_3}{\rightarrow} E + P \\
&EI \rightleftharpoons E + I \ 解离常数为K_i\\
&k_1([Et]-[ES]-[EI])[S] = k_2[ES] + k_3[ES] \\
&([Et]-[ES]-[EI])[S] = \frac{k_2+k_3}{k_1}[ES] \\
&令 K_m = \frac{k_2+k_3}{k_1} \\
&\begin{align}
&([Et]-[ES]-[EI])[S] = K_m[ES] \\
&([Et]-[ES]-[EI])[I] = K_i[EI] \\
\end{align} \\
& (1),\ (2)两式相除,\\
&[EI] = \frac{[I]K_m[ES]}{[S]K_i} \\
&上式代入\ (1)式,\\
&[ES] = \frac{[Et][S]}{K_m(1+[I]/K_i)+[S]} \\
&v = k_3[ES] = \frac{k_3[Et][S]}{K_m(1+[I]/K_i)+[S]} \\
&\because V_{max}=k_3[Et] \\
&v = \frac{V_{max}[S]}{K_m(1+\frac{[I]}{K_i})+[S]}
\end{aligned}
\]
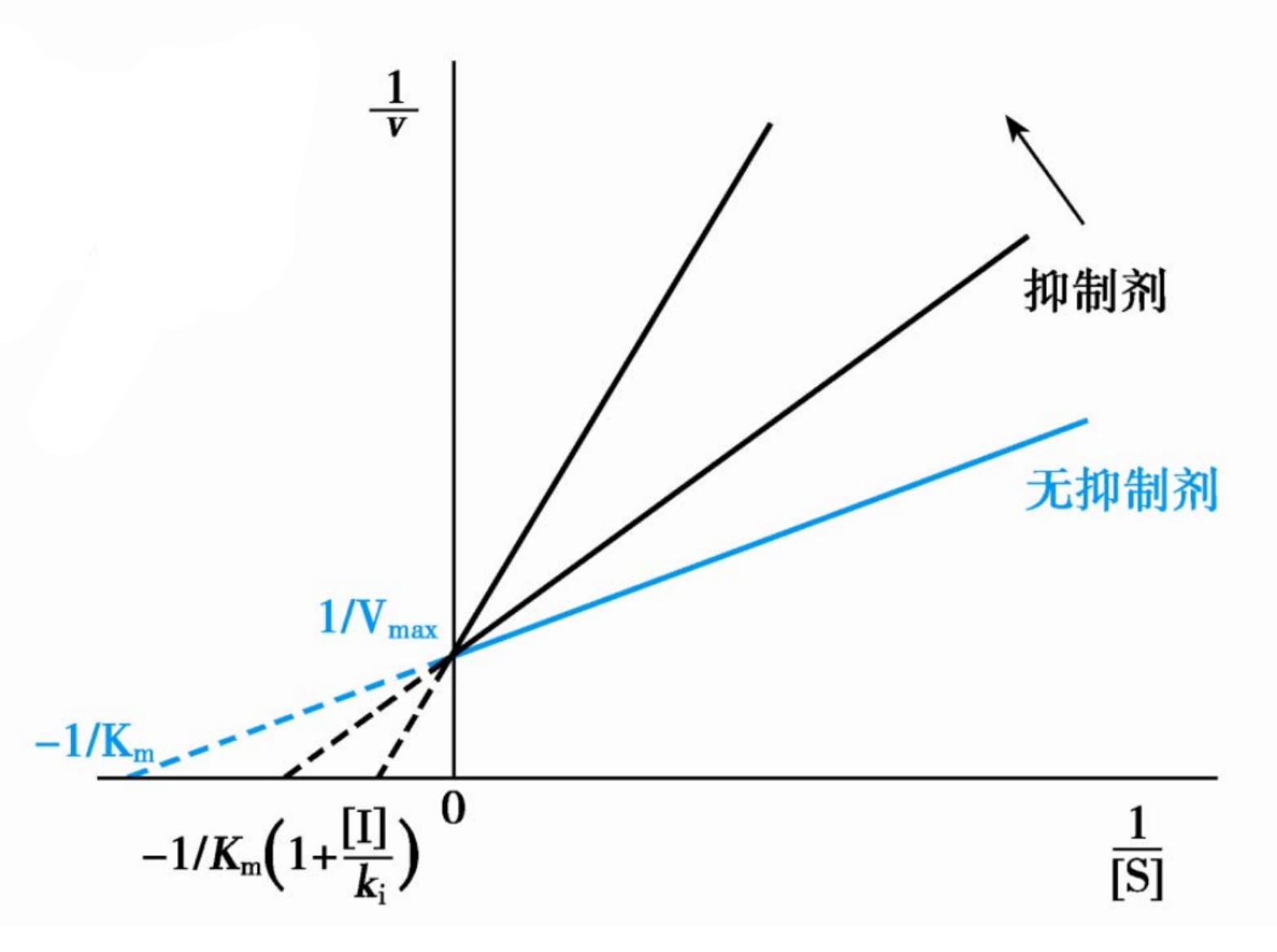
由\(\displaystyle{v = \frac{V_{max}[S]}{K_m(1+\frac{[I]}{K_i})+[S]}}\),可以得到以下结论:
- 当\([S]>>K_m\),即底物浓度足够高的时候,\(v=V_{max}\),这很容易理解,因为竞争性抑制剂竞争不过高浓度的底物。
- 当\(v = V_{max}/2\)时候,\([S] = K_m(1+\frac{[I]}{K_i})\),即表观\(K_m\)增大。当竞争性抑制剂存在的时候,酶与底物的亲和力降低是显然的。
非竞争性抑制剂
关于非竞争性抑制对米-曼方程的影响推导如下:
\[
\begin{aligned}
&假设有额外反应,抑制剂为 I \\
&E + S \ \overset{k_1}{\underset{k_2}{\rightleftharpoons}}\ ES \overset{k_3}{\rightarrow} E + P \\
&EI \rightleftharpoons E + I \ 解离常数为K_i\\
&ESI \rightleftharpoons ES + I \ 解离常数为K_i \\
&EI + S \rightleftharpoons ESI \\
&k_1([Et]-[ES]-[EI]-[ESI])[S] = k_2[ES] + k_3[ES] \\
&([Et]-[ES]-[EI]-[ESI])[S] = \frac{k_2+k_3}{k_1}[ES] \\
&令 K_m = \frac{k_2+k_3}{k_1}, 有原式\\
&([Et]-[ES]-[EI]-[ESI])[S] = K_m[ES] \\
&\begin{align}
&[EI] = \frac{[E][I]}{K_i} = \frac{K_m[ES][I]}{K_i[S]} \\
&[ESI] = \frac{[ES][I]}{K_i} \\
\end{align} \\
&(3),\ (4)式代入原式,有 \\
&[ES] = \frac{[Et][S]}{(K_m+[S])(1+\frac{[I]}{K_i})} \\
&v = k_3[ES] = \frac{k_3[Et][S]}{(K_m+[S])(1+\frac{[I]}{K_i})} = \frac{[S]}{K_m+[S]}\cdot\frac{V_{max}}{1+\frac{[I]}{K_i}}
\end{aligned}
\]
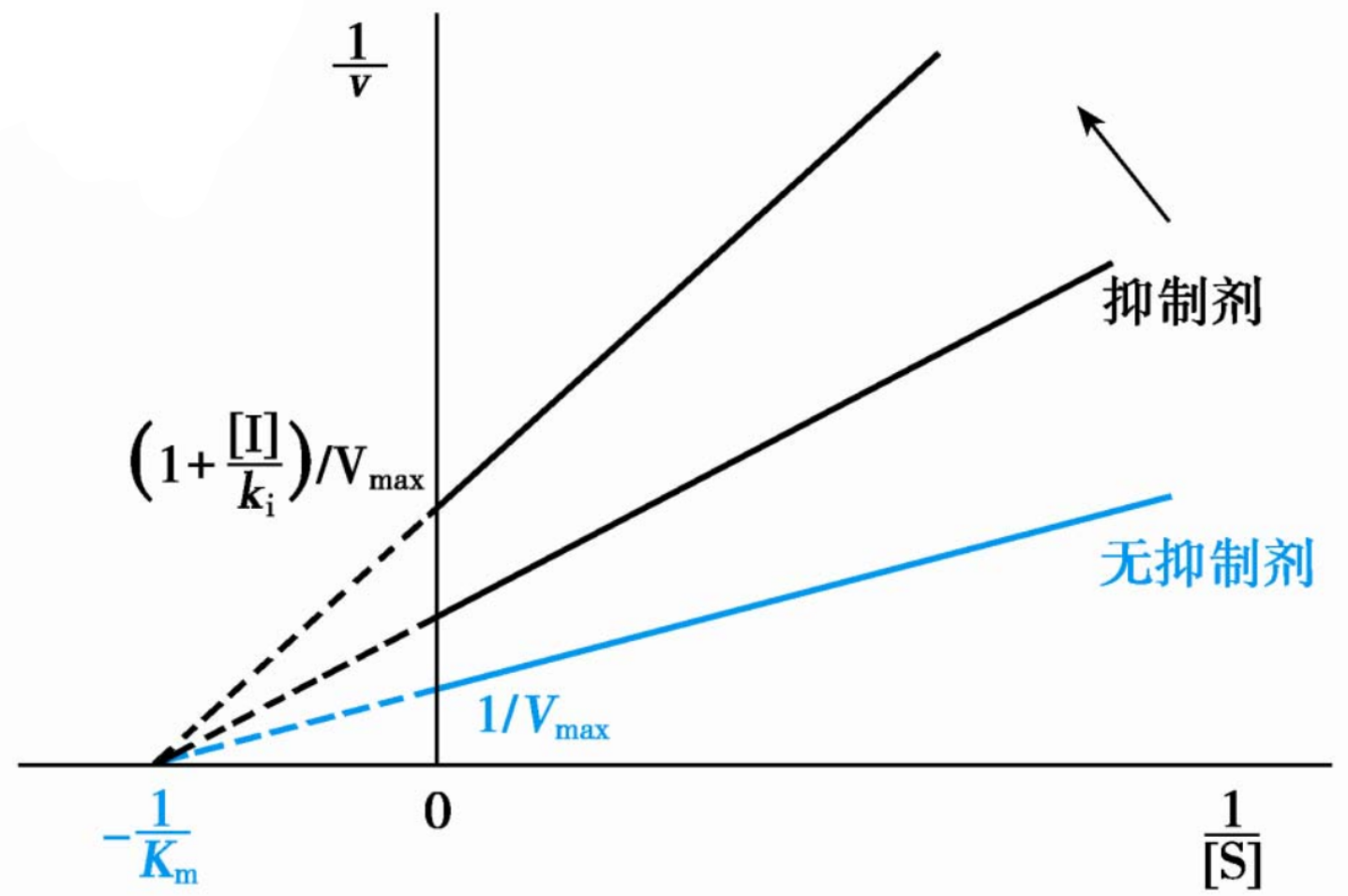
由\(\displaystyle{v=\frac{[S]}{K_m+[S]}\cdot\frac{V_{max}}{1+\frac{[I]}{K_i}}}\),可得到以下结论:
- 当\([S] >> K_m\)时候,\(\displaystyle{v=\frac{V_{max}}{1+\frac{[I]}{K_i}}}\),即\(V_{max}\)下降。
- 当\([S] = K_m\)时,\(\displaystyle{v=\frac{V_{max}}{2(1+\frac{[I]}{K_i})}}\),即表观\(K_m\)不变。
反竞争性抑制剂
关于非竞争性抑制对米-曼方程的影响推导如下:
\[
\begin{aligned}
&假设有额外反应,抑制剂为 I \\
&E + S \ \overset{k_1}{\underset{k_2}{\rightleftharpoons}}\ ES \overset{k_3}{\rightarrow} E + P \\
&ESI \rightleftharpoons ES + I \ 解离常数为K_i \\
&EI + S \rightleftharpoons ESI \\
&k_1([Et]-[ES]-[ESI])[S] = k_2[ES] + k_3[ES] \\
&([Et]-[ES]-[ESI])[S] = \frac{k_2+k_3}{k_1}[ES] \\
&令 K_m = \frac{k_2+k_3}{k_1}, 有原式\\
&([Et]-[ES]-[ESI])[S] = K_m[ES] \\
&\begin{align}
&[ESI] = \frac{[ES][I]}{K_i} \\
\end{align} \\
&(5)式代入原式,有 \\
&[ES] = \frac{[Et][S]}{K_m+[S](1+\frac{[I]}{K_i})} \\
&v = k_3[ES] = \frac{k_3[Et][S]}{K_m+[S](1+\frac{[I]}{K_i})} = \frac{[S]}{\frac{K_m}{1+\frac{[I]}{K_i}}+[S]}\cdot\frac{V_{max}}{1+\frac{[I]}{K_i}}
\end{aligned}
\]
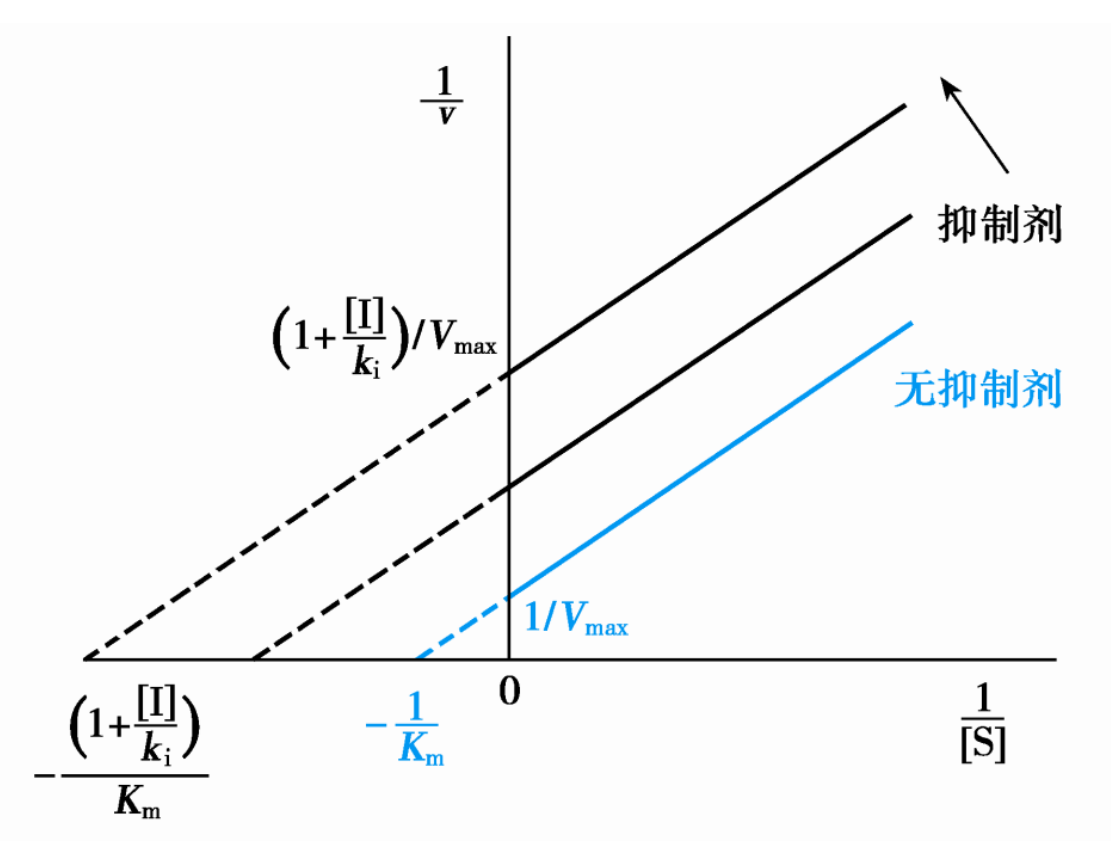
由\(\displaystyle{v = \frac{[S]}{\frac{K_m}{1+\frac{[I]}{K_i}}+[S]}\cdot\frac{V_{max}}{1+\frac{[I]}{K_i}}}\),可得到以下结论:
- 当\([S] >> K_m\)时,\(\displaystyle{v = \frac{V_{max}}{1+\frac{[I]}{K_i}}}\),即\(V_{max}\)下降。
- 当\([S] = \frac{K_m}{1+\frac{[I]}{K_i}}\),\(\displaystyle{v = \frac{V_{max}}{2(1+\frac{[I]}{K_i})}}\),即表观\(K_m\)下降。(由于I抑制了ES解离或者进一步反应,消耗了ES浓度,使得E与S结合的化学平衡右移)
激活剂可提高酶促反应速率
激活剂是一种使酶由无活性变为有活性或使酶活性增加的物质,分为必需激活剂和非必需激活剂。
酶的调节
酶活性调节
对酶活性的调节是对酶促反应速率的快速调节,主要有以下三种方式:
- 别构效应剂通过改变酶的构象而调节酶活性
- 酶的化学修饰调节,通过某些化学基团与酶的共价可逆结合来实现
- 酶原需要通过激活过程才能转变为有活性的酶
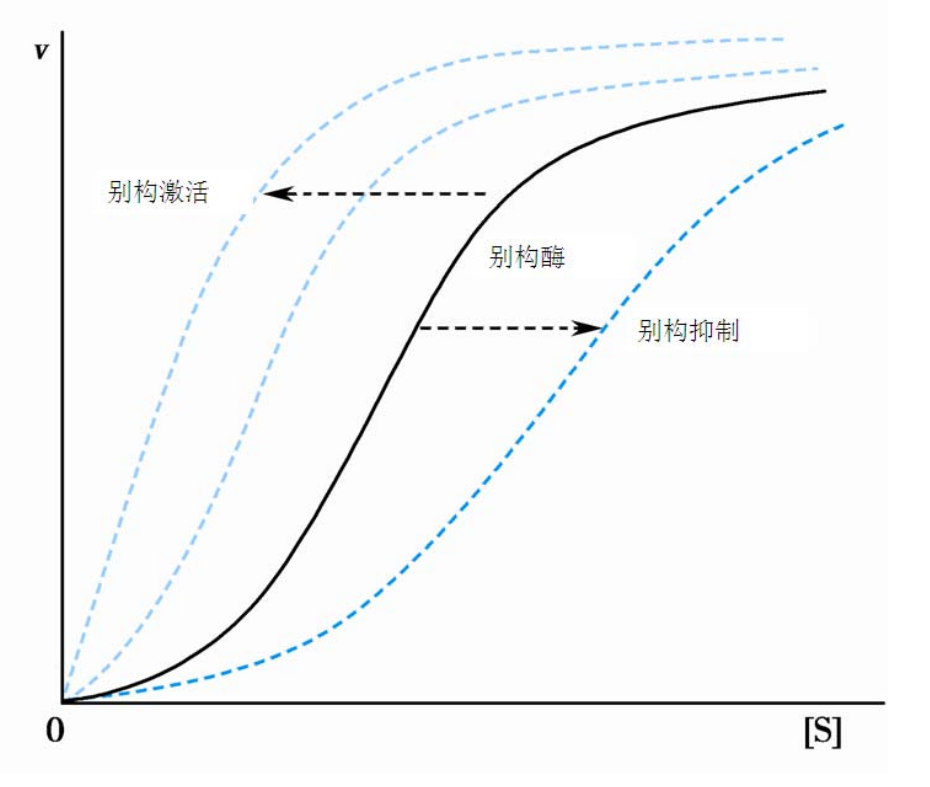
别构调节
别构调节指的是体内一些代谢物与酶的活性中心以外的某个部位非共价可逆结合,引起酶的构象改变,从而改变酶的活性的调节方式。
支持这样调节的酶被称为别构酶,引起别构效应的被称为别构效应剂,根据作用效果不同又分为别构抑制剂和别构激活剂,别构酶上别构效应剂的作用位点被称为别构部位。
化学修饰调节
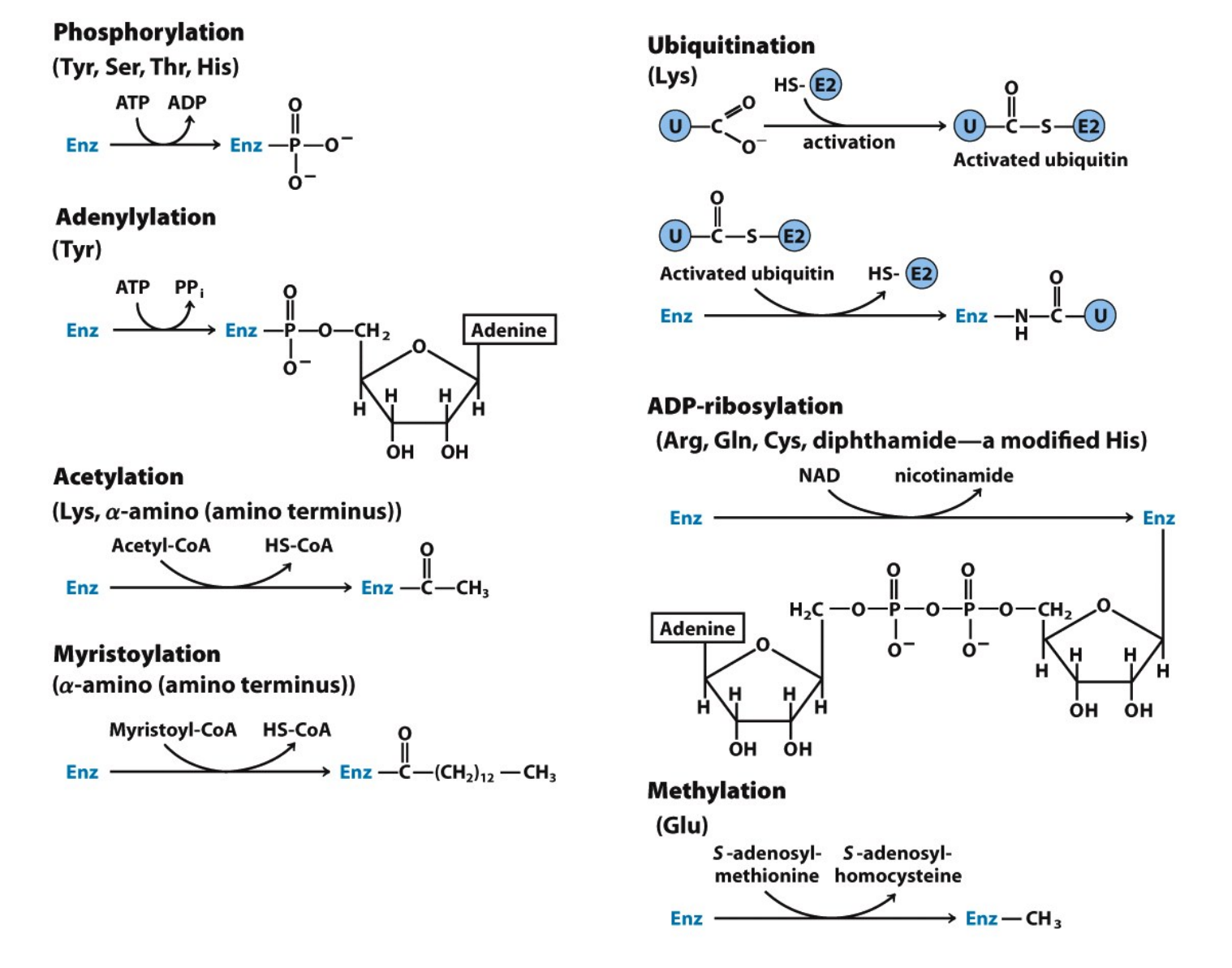
酶蛋白肽链上的一些基团可以在其它酶的催化下,与某些化学基团共价结合,同时又可在另一种酶的催化下,去掉已结合的化学基团,从而影响酶的活性。这种调节方式被称为酶的化学修饰(。
比较典型的是酶的磷酸化/去磷酸化,以下列举了多种化学修饰调节方式。
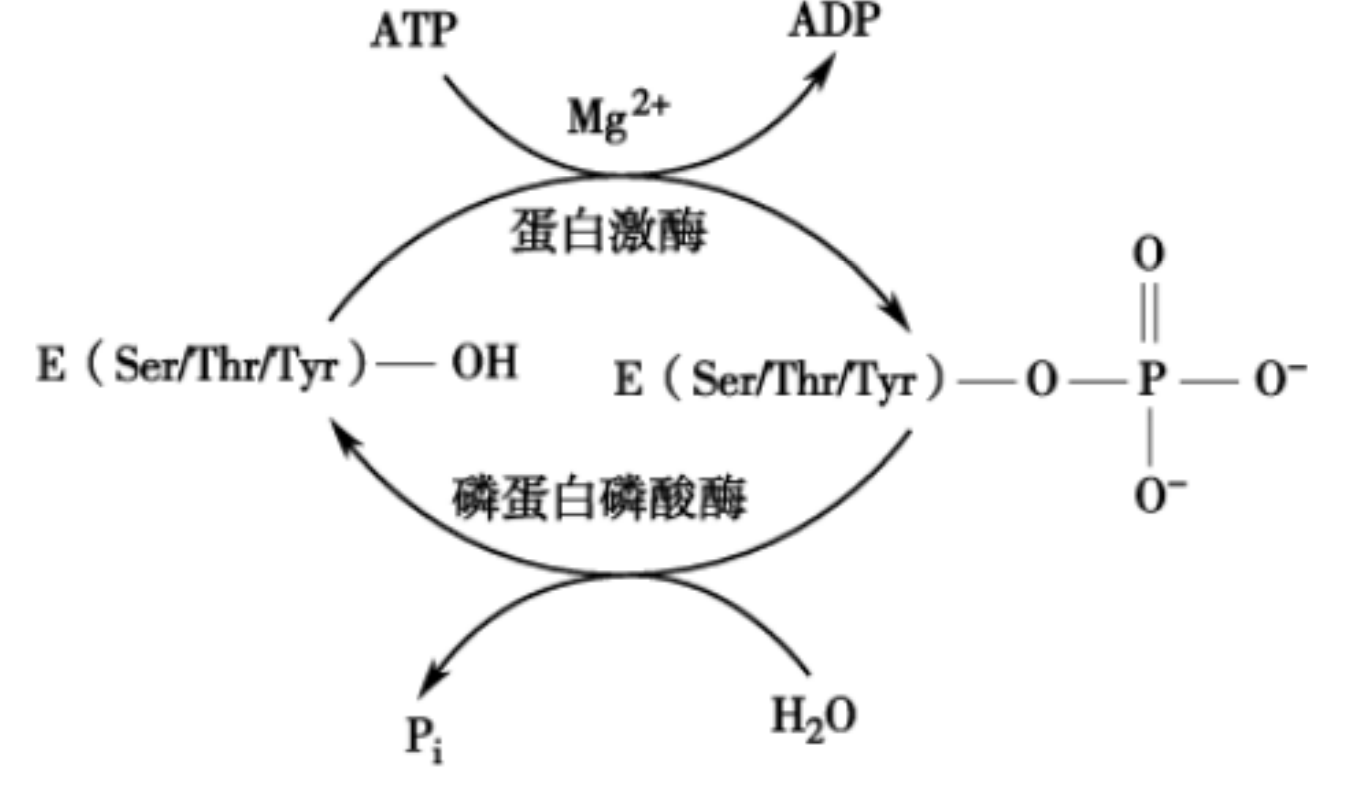
蛋白激酶
对酶进行磷酸化修饰的酶被称为蛋白激酶,而去磷酸化的被称为磷蛋白磷酸酶。
而蛋白激酶具有底物特异性,不同的蛋白激酶会磷酸化特定的氨基酸序列,而一个酶上可能会存在多个磷酸化位点,由一个或多个蛋白激酶共同调控。
| Protein kinase |
Consensus sequence and phosphorylated residue* |
| 蛋白激酶A(Protein kinase A, PKA) |
-x-R-[RK]-x-[ST]-B- |
| 蛋白激酶G(Protein kinase G, PKG) |
-x-R-[RK]-x-[ST]-x- |
| 蛋白激酶C(Protein kinase C, PKC) |
-RK-x-[ST]-B-RK- |
| 蛋白激酶B(Protein kinase B, Akt/PKB) |
-x-R-x-[ST]-x-K- |
| 钙/钙调蛋白依赖性蛋白激酶I(Ca2+/calmodulin kinase I, CaMKI) |
-B-x-R-x(2)-[ST]-x(3)-B- |
| 钙/钙调蛋白依赖性蛋白激酶II(Ca2+/calmodulin kinase II, CaMKII) |
-B-x-[RK]-x(2)-[ST]-x(2)- |
| 肌球蛋白轻链激酶(平滑肌)(Myosin light chain kinase, MLCK) |
-K(2)-R-x(2)-S-x-B(2)- |
| 磷酸化酶b激酶(Phosphorylase b kinase) |
-K-R-K-Q-I-S-V-R- |
| 细胞外信号调节激酶(Extracellular signal–regulated kinase, ERK) |
-P-x-[ST]-P(2)- |
| 周期蛋白依赖性激酶(Cyclin-dependent protein kinase, Cdc2/Cdk1) |
-x-[ST]-P-x-[KR]- |
| 酪蛋白激酶I(Casein kinase I, CK1) |
-[SpTp]-x(2)-[ST]-B† |
| 酪蛋白激酶II(Casein kinase II, CK2) |
-x-[ST]-x(2)-[ED]-x- |
| β-肾上腺素能受体激酶(β-Adrenergic receptor kinase, βARK) |
-DE-[ST]-x(3) |
| 视紫红质激酶(Rhodopsin kinase, GRK1) |
-x(2)-[ST]-E(n)- |
| 胰岛素受体激酶(Insulin receptor kinase, IRK) |
-x-E(3)-Y-M(4)-K(2)-S-R-G-D-Y-M-T-M-Q-I-G-K(3)-L-P-A-T-G-D-Y-M-N-M-S-P-V-G-D- |
| 表皮生长因子受体激酶(Epidermal growth factor receptor kinase, EGFR) |
-E(4)-Y-F-E-L-V- |
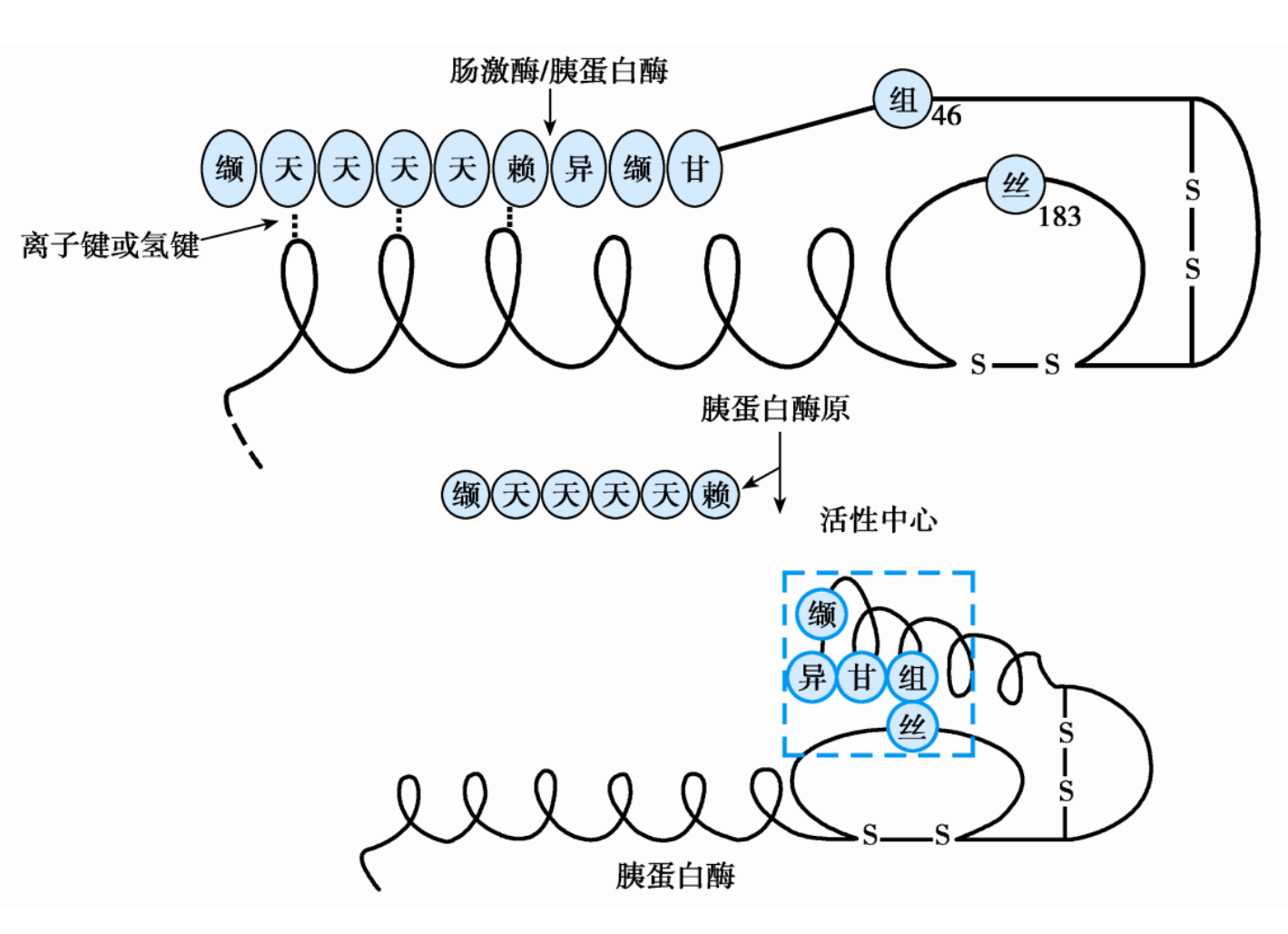
酶原
酶原是酶没有活性的前体,需要激活才能转变为有催化活性的酶,其本质是活性中心的暴露。
为什么需要以酶原的形式生产酶?因为有些酶很危险(比如水解酶),一不小心错误释放可能会一拳干碎细胞本身。所以酶原与其激活机制是一种保证酶在特定的环境和部位发挥其催化作用,对机体起保护作用。
其中的经典莫过于胰蛋白酶的激活。
酶含量调节
酶含量的调节是对酶促反应速率的缓慢调节,主要发生在两个方向上:酶的合成与酶的降解。
- 酶的合成:主要在转录水平上调控酶的合成。能促进酶基因转录的被称为诱导物,该作用被称为诱导作用;能阻遏酶基因转录的被称为阻遏蛋白,能激活阻遏蛋白活性的被称为辅阻遏物,该作用被称为阻遏作用。
- 酶的降解:与一般蛋白降解途径相同,有溶酶体途径(非ATP依赖性蛋白质降解途径)和胞质途径(ATP依赖性泛素介导的蛋白质降解途径)。































