蛋白质的结构与功能
本章节要求如下:
掌握
- 组成蛋白质的20种氨基酸的结构特点、分类及其三字母缩写符号
- 蛋白质一级结构的概念,理解肽键、肽单元等概念及其结构特点
- 蛋白质的级、三级、四级结构的概念及其特点
- 体、结构域的概念
- 蛋白质各级结构与功能的关系,掌握别构效应、协同效应的概念
熟悉
氨基酸、蛋白质的理化性质及有关的基本概念,如两性解离与等电点、变性、紫外吸收等。
了解
- 蛋白质的重要生理功能
- 重要的生物活性肽
- 蛋白质分离纯化的主要方法及其基本原理
- 多肽链中氨基酸的序列分析方法及其原理
- 蛋白质空间结构测定的基本原理
蛋白质的严格定义为:由氨基酸 (amino acids)通过肽键 (peptide bond)相连形成的高分子含氮化合物。
蛋白质分子组成
组成蛋白质的元素包括有:碳氢氧氮硫(主要元素)与磷铁铜锌锰钴钼碘(其他元素)。
不同蛋白质中各种元素的质量占比差异较大,但氮元素却比较接近——都在16%附近,而生物体中的氮元素主要集中在蛋白质中,所以我们可以通过生物样品含氮量估计蛋白质总量:
氨基酸
本章重点!!!
氨基酸基本结构
接下来我们介绍蛋白质的基本组成单位——氨基酸。
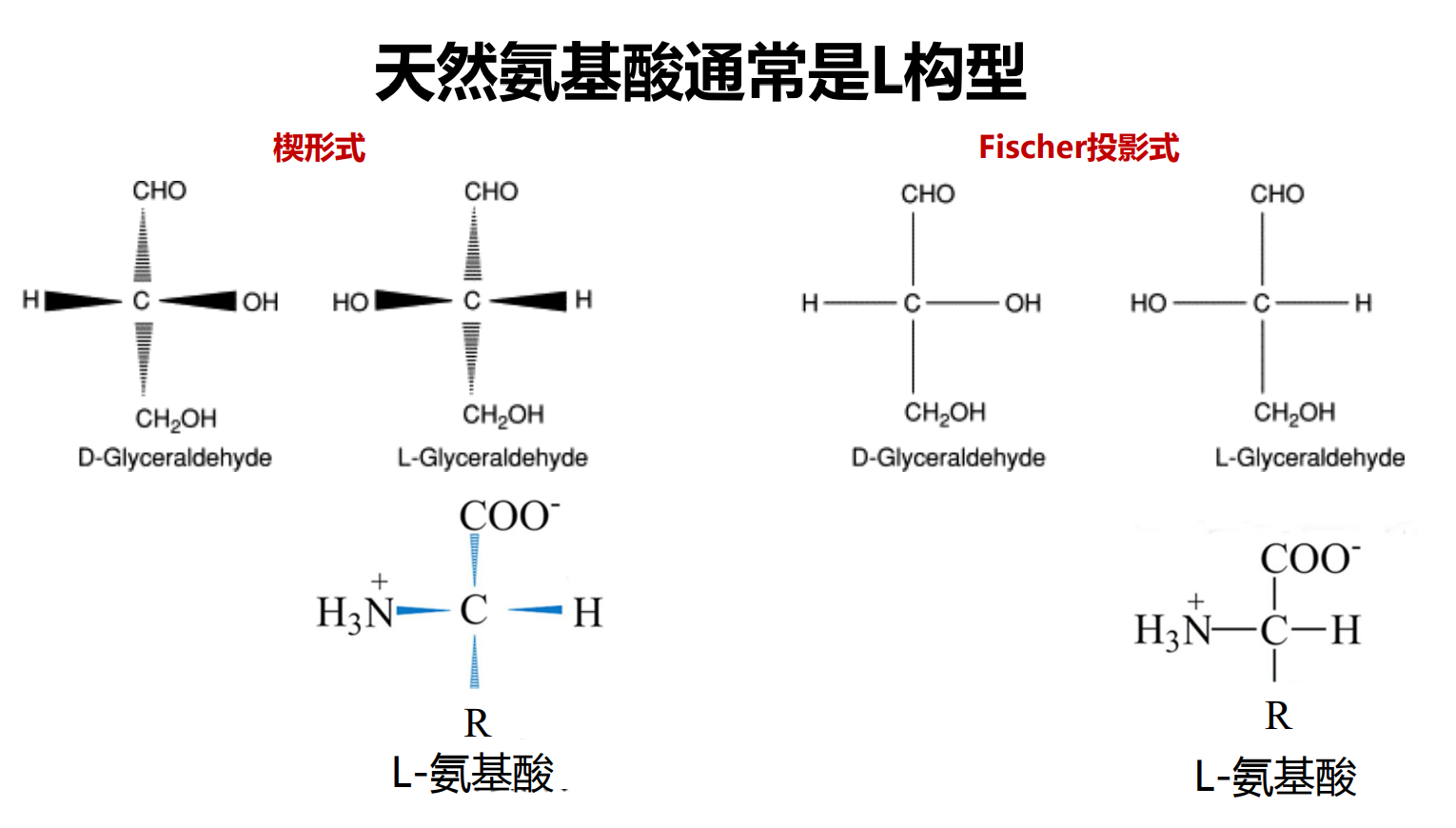
自然界有多达300种氨基酸,但组成人体的氨基酸只有区区20种,它们都属于\(L-\alpha-氨基酸\)(除了甘氨酸,它没有手性)。
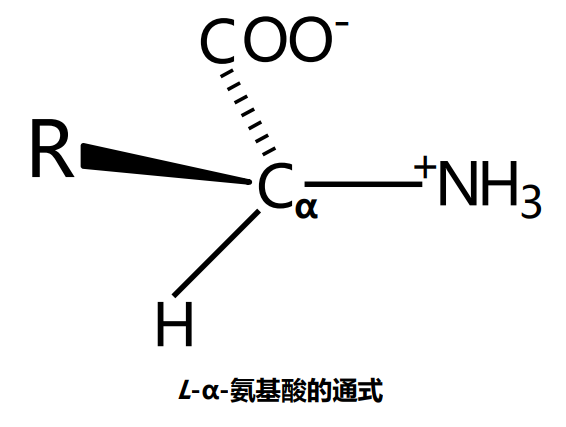
我们对氨基酸手性的判断基于甘油醛的Fischer投影式:
氨基酸的分类
氨基酸基于侧链结构与理化性质可以分为五类:非极性脂肪族氨基酸、芳香族氨基酸、极性中性氨基酸、酸性氨基酸、碱性氨基酸。
它们可以被类似于元素周期表的方式分类为下面这张图:

其中有几种特殊氨基酸:
- 脯氨酸:它的R基与氨基链接成环,形成亚氨基酸。
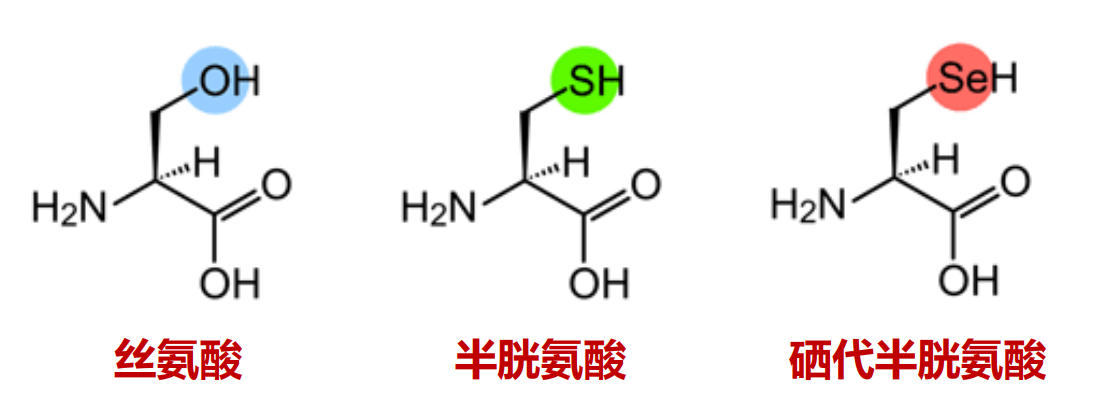
- 半胱氨酸:两个半胱氨酸的巯基可以缩合为一个二硫键(胱氨酸)。
除了以上20种基本的氨基酸以外,近年来的研究还发现硒代半胱氨酸在某些情况下也可以被用于合成蛋白质,结构上来看,硒代半胱氨酸以硒原子代替了半胱氨酸上的硫原子。其一般存在于过氧化物酶和电子传递链中的还原酶。
翻译后修饰
在蛋白质翻译后的修饰过程中,脯氨酸和赖氨酸可分别 被羟化为羟脯氨酸和羟赖氨酸;蛋白质分子中的某些基团还可被甲基化、甲酰化、乙酰化、异戊二烯化和磷酸化等。
这些翻译后修饰,可改变蛋白质的溶解度、稳定性、亚细胞定位和与其他细胞蛋白质相互作用的性质等,体现了蛋白质生物多样性的一个方面。
体内也存在若干不参与蛋白质合成但具有重要生理作用的 \(L-α-氨基酸\) ,如参与合成尿素的鸟氨酸 (ornithine)、瓜氨酸 (citrulline)和精氨酸代琥珀酸 (argininosuccinate)。
氨基酸的理化性质
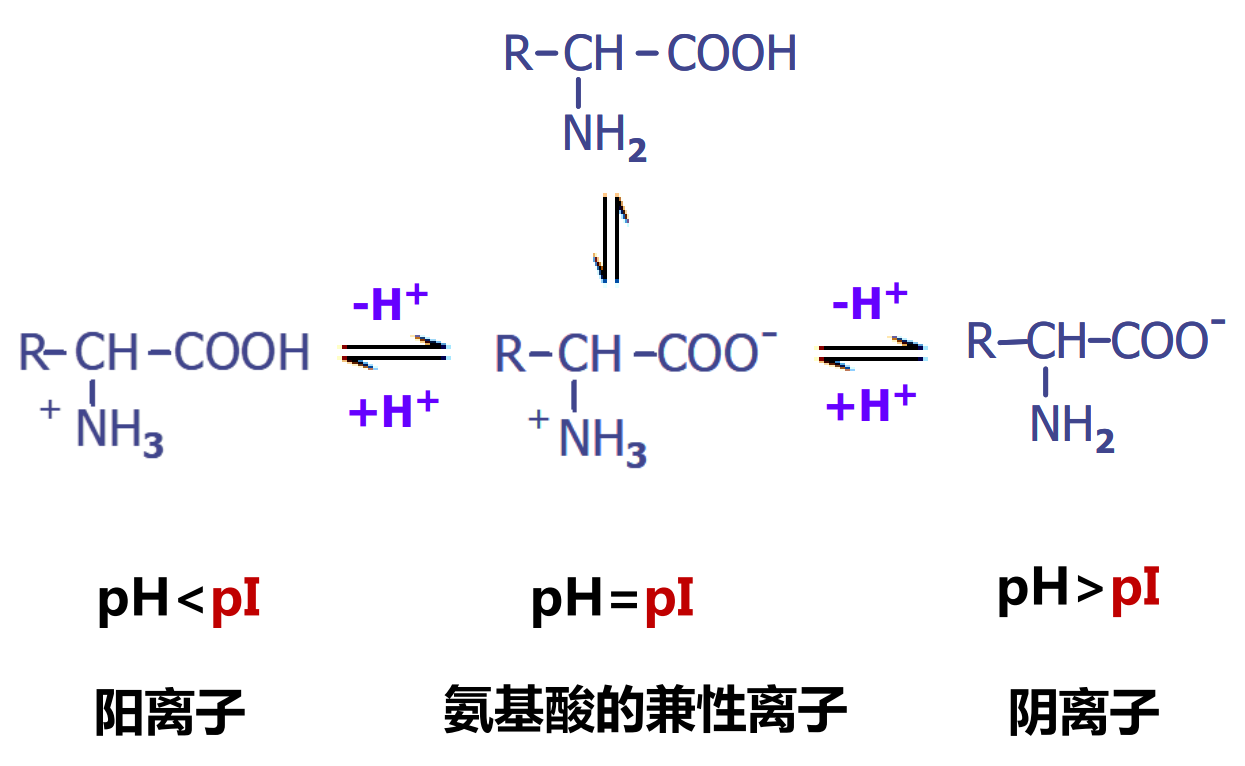
氨基酸是典型的两性化合物,具有两性解离与等电点的性质,其解离程度取决于溶液pH。
等电点
在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。此时溶液的pH值称为该氨基酸的等电点(isoelectric point,pl)。
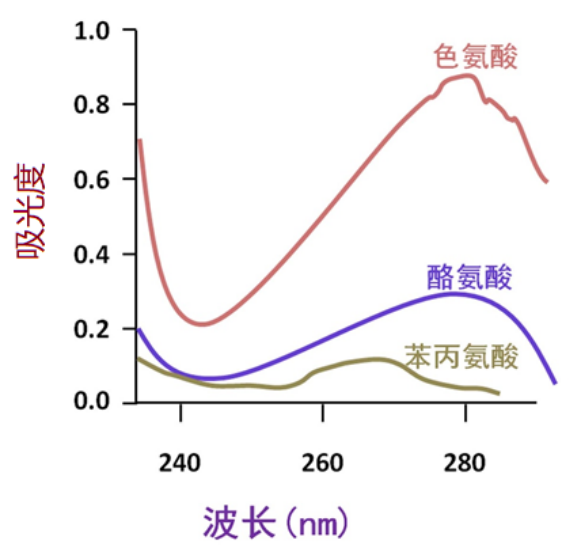
其次,含有共轭双键的氨基酸具有紫外吸收的性质。
色氨酸、酪氨酸的最大吸收峰在280nm附近,大多数蛋白质都含有这两个氨基酸残基,所以测定蛋白质溶液280nm的光吸收值是分析溶液中蛋白质含量的快速简便的方法。
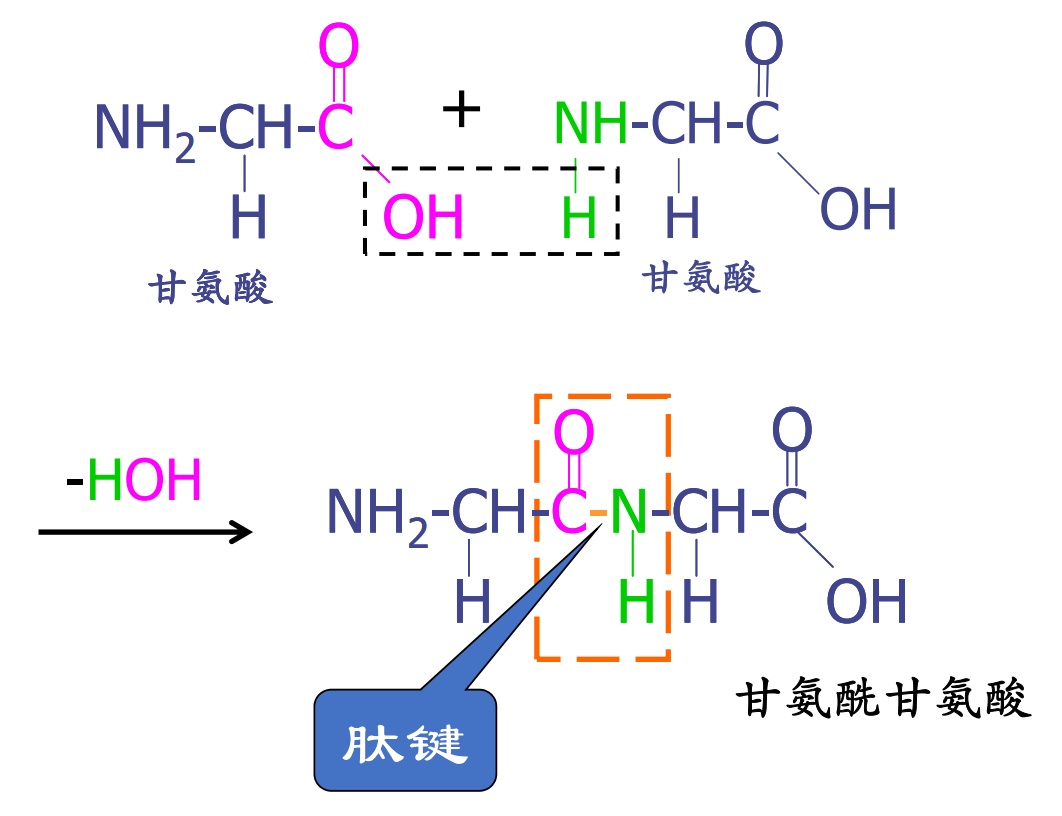
肽键与肽链
肽键(peptide bond)是由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键。氨基酸之间以肽键作为连接,从而形成多肽或更复杂的蛋白质。
更多的氨基酸,更长的肽链
我们一般将2-20个氨基酸形成的肽链称之为寡肽,大于20个氨基酸的为多肽,大于50个氨基酸的为蛋白质。
对于一条肽链,其具有方向性,存在两个不同的末端:
- 氨基末端(N-端):多肽链中有游离α-氨基的一端。
- 羧基末端(C-端):多肽链中有游离α-羧基的一端。
肽链中的脱水缩合后的氨基酸分子被称为氨基酸残基( residue )。
生物活性肽
这里介绍两种特殊的生物活性肽:谷胱甘肽与促甲状腺素释放激素。
生物活性肽
具有营养以外的生理作用的蛋白质片段,例如抗氧化、抗高血压或抗菌特性
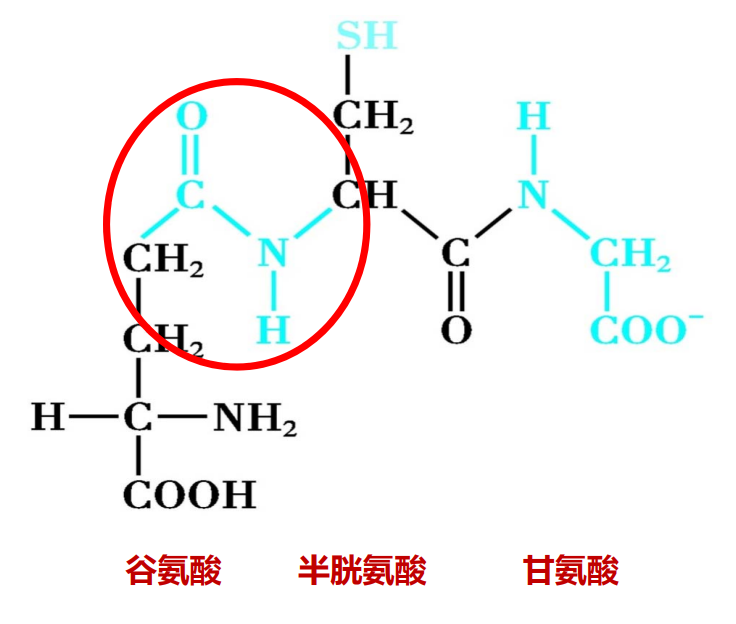
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸依次缩合形成的三肽化合物,其中半胱氨酸的巯基具有还原性。
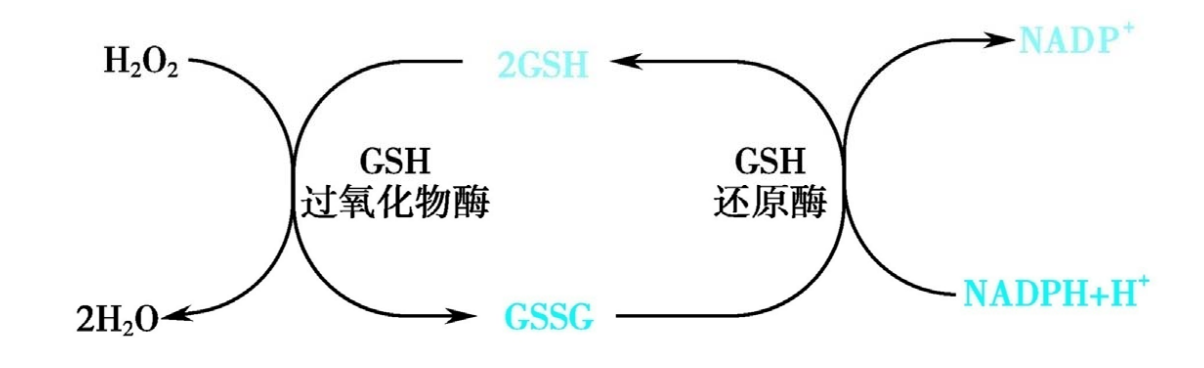
谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)之间可以发生转化,是细胞抗氧化,维持胞内还原环境的重要生物分子。
促甲状腺素释放激素是由焦谷氨酸、组氨酸和脯氨酰胺缩合形成的三肽化合物,主要由下丘脑分泌。
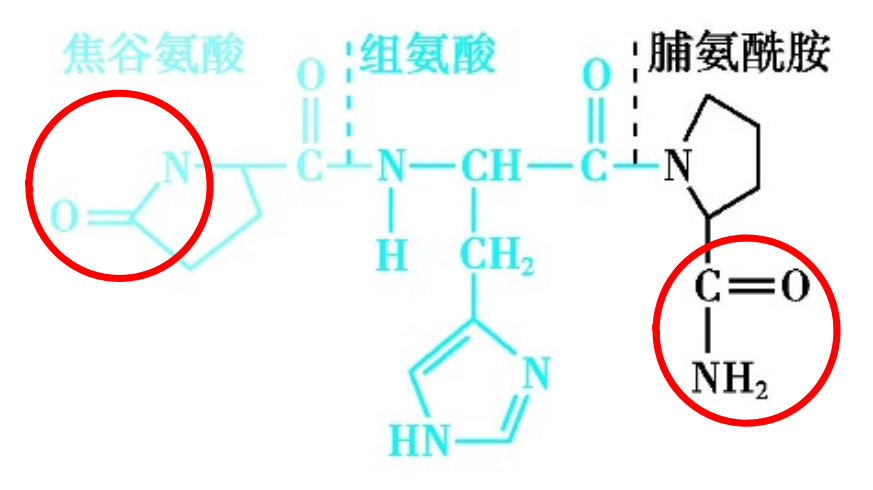
蛋白质分子结构
本章节重点!!!
一级结构
蛋白质的一级结构指在蛋白质分子从N-端至C-端的氨基酸排列顺序,主要包含肽键,某些蛋白存在二硫键。
一级结构是蛋白质空间构象和特异生物学功能的基础,但不是决定蛋白质空间构象的唯一因素。
蛋白质的一级结构可以直接测出氨基酸序列,而氨基酸序列承载了部分生物遗传信息,所以通过对动物某段保守的,共有的氨基酸序列的差异分析可以推断其在进化树上的位置。具体实践中我们一般选用细胞色素C,它是线粒体电子传递链的成分。
二级结构
二级结构指在蛋白质分子局部有规则重复的主链构象,即该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。肽链主链骨架原子包括α-碳原子(Cα)、羰基碳原子(Co)、氨基氮原子(N)。主要涉及到的化学键为氢键。
Note
简而言之,二级结构更关注肽链的某些局部是如何被折叠的,也就是链条上出现的特征形状。
一级结构与二级结构的联系:氨基酸残基的侧链影响二级结构的形成,蛋白质二级结构是以一级结构为基础的。一段肽链其氨基酸残基的侧链适合形成α-螺旋或B-折叠,它就会出现相应的二级结构。
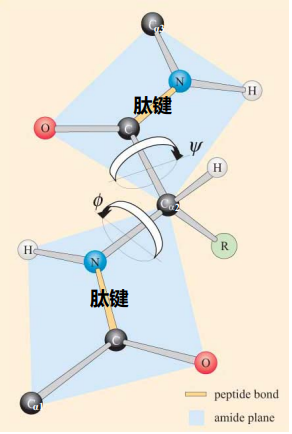
肽平面
参与肽键形成的6个原子 (\(\ce{C_{\alpha 1}, C, O, N, H, C_{\alpha 2}}\)) 在同一平面上,其构成了肽平面/肽单元。
\(\ce{C_{\alpha 1}}\) 和 \(\ce{C_{\alpha 2}}\)在平面上处于反式构型。肽平面绕\(\ce{N-C_\alpha}\)旋转角度为\(\varphi\),绕\(\ce{C_\alpha-C}\)键的旋转角度称为\(\psi\)。
常见的蛋白质二级结构:
- \(\alpha\)-螺旋 (\(\alpha\)-helix)
- \(\beta\)-折叠 (\(\beta\)-sheet)
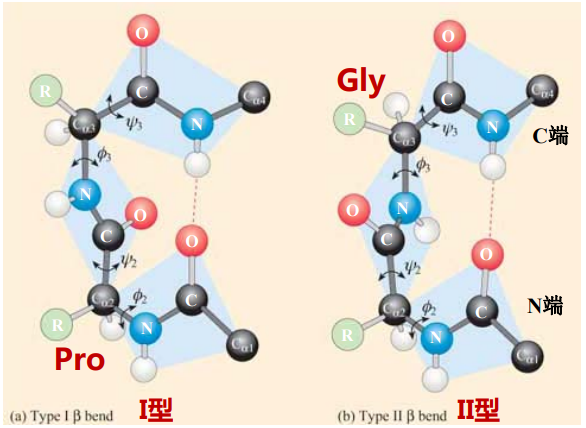
- \(\beta\)-转角 (\(\beta\)-turn)
- \(\Omega\)-环 (\(\Omega\)-loop)
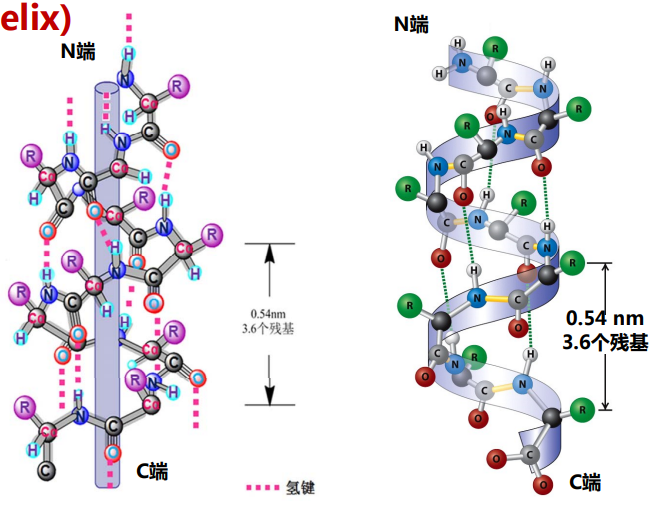
α螺旋
肽链在氢键作用下会折叠为右手螺旋,一圈3.6个残基,螺距0.54nm。
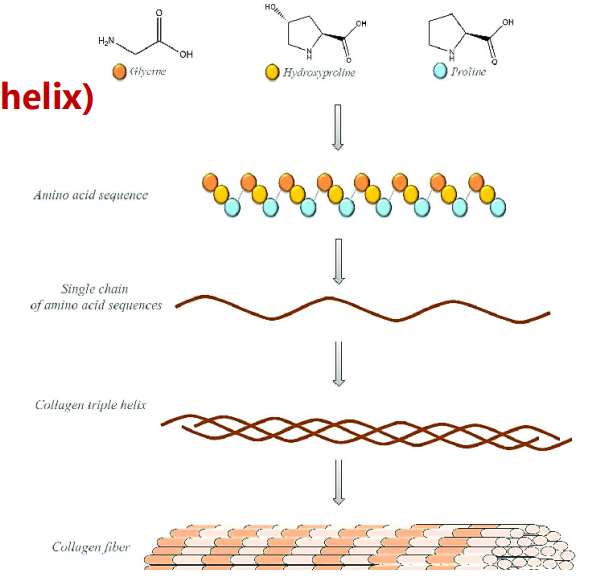
胶原蛋白会形成三螺旋结构。
β折叠
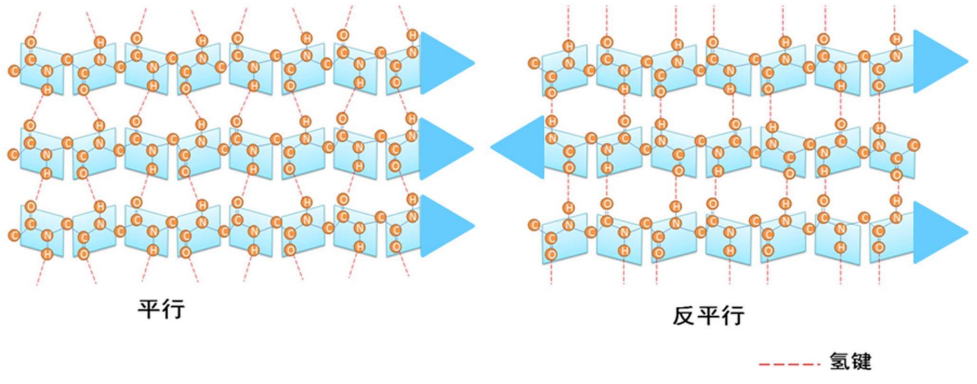
β转角
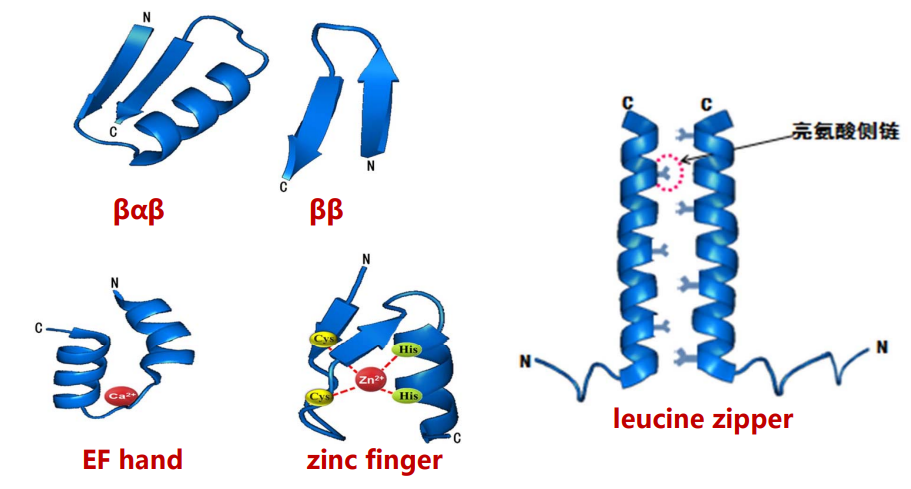
模体
模体,即超二级结构,指的是二个或三个具有二级结构的肽段,在空间上相互接近,形成一个有规则的二级结构组合。
Note
可以将模体理解为是一种对二级结构的封装,形成一个常用的模块,比如EF hand就是一个常见的可与钙离子结合的模体。
此处仍存在疑惑!!!
结构域
分子量较大的蛋白质常可折叠成多个结构较为紧密且稳定的区域,并各行其功能,称为结构域(domain)。
Note
大多数结构域含有序列上连续的100至200个氨基酸残基,若用限制性蛋白酶水解,含多个结构域的蛋白质常分解出独立的结构域,而各结构域的构象可以基本不改变,并保持其功能。
三级结构
三级结构指的是整条肽链中全部氨基酸残基的相对空间位置,即肽链中所有原子在三维空间的排布位置。主要涉及到的化学键包括疏水键、离子键、氢键和范德华力等。
Note
相比二级结构,三级结构引入了对R基的考量,同时也将视角提升到了整条肽链的三维结构。
而在这条肽链三维结构的形成与维持中,R基之间的相互作用功不可没。
下图展示了肌红蛋白的三级结构。
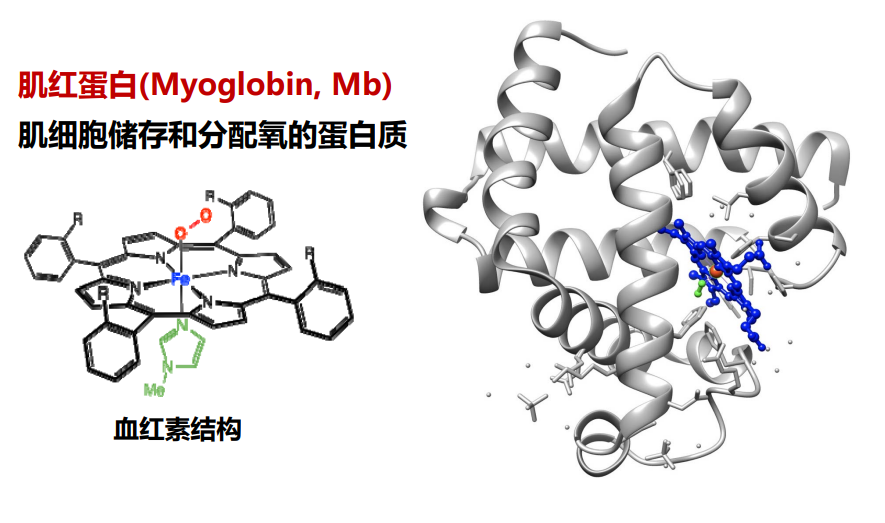
三级结构涉及到了氨基酸残基上R基的相互作用,它们共同参与三级结构的形成与维持,下图展示了一条肽链在三级结构中可能会涉及到的R基相互作用方式。
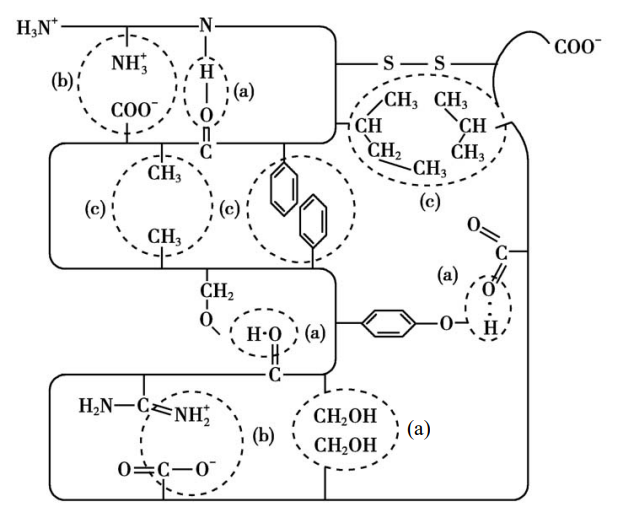
四级结构
许多功能性蛋白质分子含有2条或2条以上多肽链。每一条多肽链都有完整的三级结构,称为蛋白质的亚基(subunit)。蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构(quaternary structure)。主要的化学键包括有疏水键、离子键、氢键和范德华力等。
四级结构可分类如下:
- 同二聚体(homodimer)
- 异二聚体(heterodimer)
- 同三聚体(homotrimer)
- 异三聚体(heterotrimer)
- 同四聚体(homotetramer)
- 异四聚体(heterotetramer)
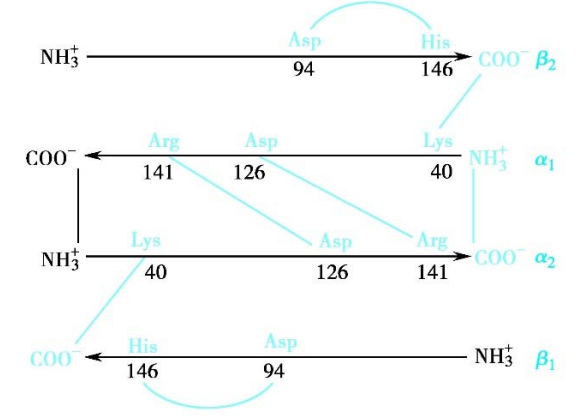
血红蛋白 (hemoglobin, Hb) 是一个典型的具有四级结构的蛋白,其四个亚基之间通过盐键相互联系。
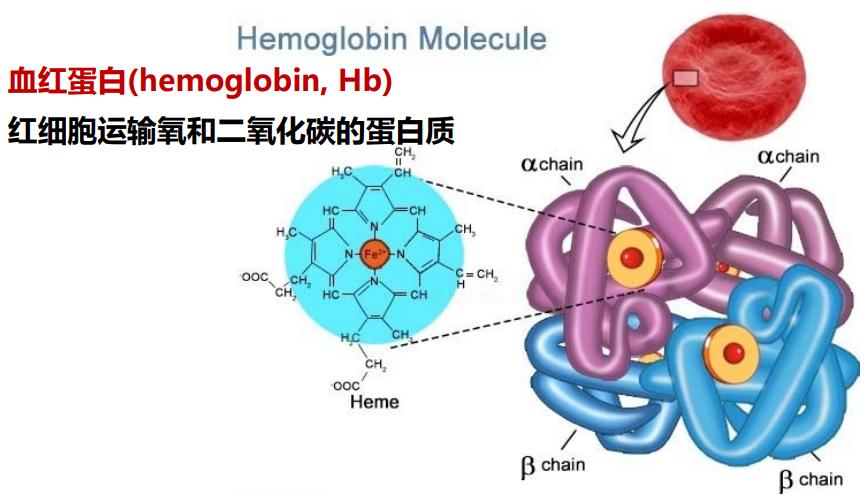
脱氧Hb亚基间和亚基内存在盐键相互连接。
Hb与Mb一样能可逆地与0,结合, Hb与O,结合后称为氧合Hb。氧合Hb占总Hb的百分数称氧饱和度。
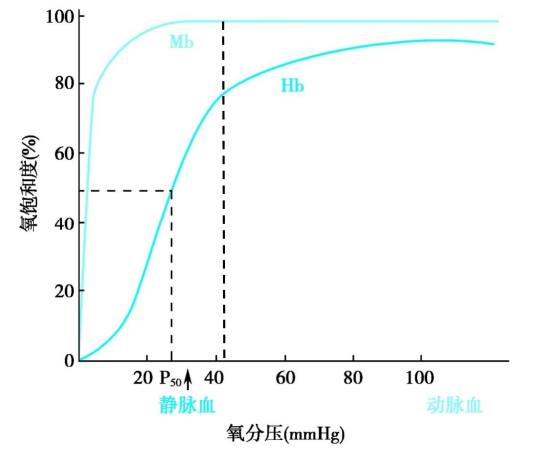
对于具有四级结构的蛋白质来说,其各个亚基之间存在相互作用,可以被描述为“寡聚体蛋白质的一个亚基与其配体结合后,能影响此寡聚体中另一个亚基与配体结合能力的现象”,这被称为协同效应 (cooperativity)。
- 促进作用,称为正协同效应(positive cooperativity)
- 抑制作用,称为负协同效应(negative cooperativity)
血红蛋白就存在有典型的协同效应。

蛋白质结构与疾病
氨基酸序列的改变可以引起疾病的发生——镰刀型贫血症,患有该病的患者的血红蛋白上一个Glu被替换为Val,导致血红蛋白的聚集,形成镰刀型红细胞。
Note
对于球状蛋白而言,非极性氨基酸和芳香族氨基酸一般位于蛋白的内部,极性氨基酸和带电荷的氨基酸一般位于蛋白的表面。对于膜蛋白而言,非极性氨基酸和芳香族氨基酸也可能位于蛋白的表面。
即使一级结构没问题,如果蛋白质在之后的折叠中发生了错误,使其构象发生改变,仍会影响其正常功能,甚至导致疾病的发生。包括人纹状体脊髓变性病、阿尔茨海默病、亨廷顿舞蹈病、疯牛病等。
蛋白质分类
依据蛋白质的组成分类:
- 单纯蛋白质(胰岛素)
- 结合蛋白质(肌红蛋白) = 蛋白质部分 + 非蛋白质部分
根据蛋白质形状分类:
- 纤维状蛋白质(胶原蛋白)
- 球状蛋白质(肌红蛋白)
蛋白质家族(protein family)
氨基酸序列相似而且空间结构与功能也十分相近的蛋白质。属于同一蛋白质家族的成员,称为同源蛋白质(homologous protein)。
蛋白质超家族(superfamily)
2个或2个以上的蛋白质家族之间,其氨基酸序列的相似性并不高,但含有发挥相似作用的同一模体结构。
蛋白质理化性质
蛋白质具有两性电离的性质
蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,在一定的溶液pH条件下都可解离成带负电荷或正电荷的基团。
蛋白质的等电点
与氨基酸类似的是,蛋白质也具有等电点(isoelectric point, pI),其指的是当蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零的时候溶液pH。
蛋白质具有胶体性质
蛋白质属于生物大分子,直径可达1~100nm,为胶粒范围之内。
蛋白质胶体稳定的因素:
- 颗粒表面电荷
- 水化膜
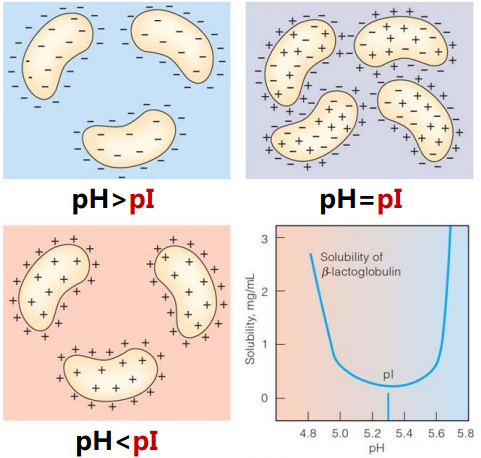
蛋白质溶解度与pH之间的关系:
- pH≠pI时候,蛋白质表面带上电荷,易溶于水这种极性溶剂。
- pH=pI时候,蛋白质表面净电荷为0,溶解度最小。
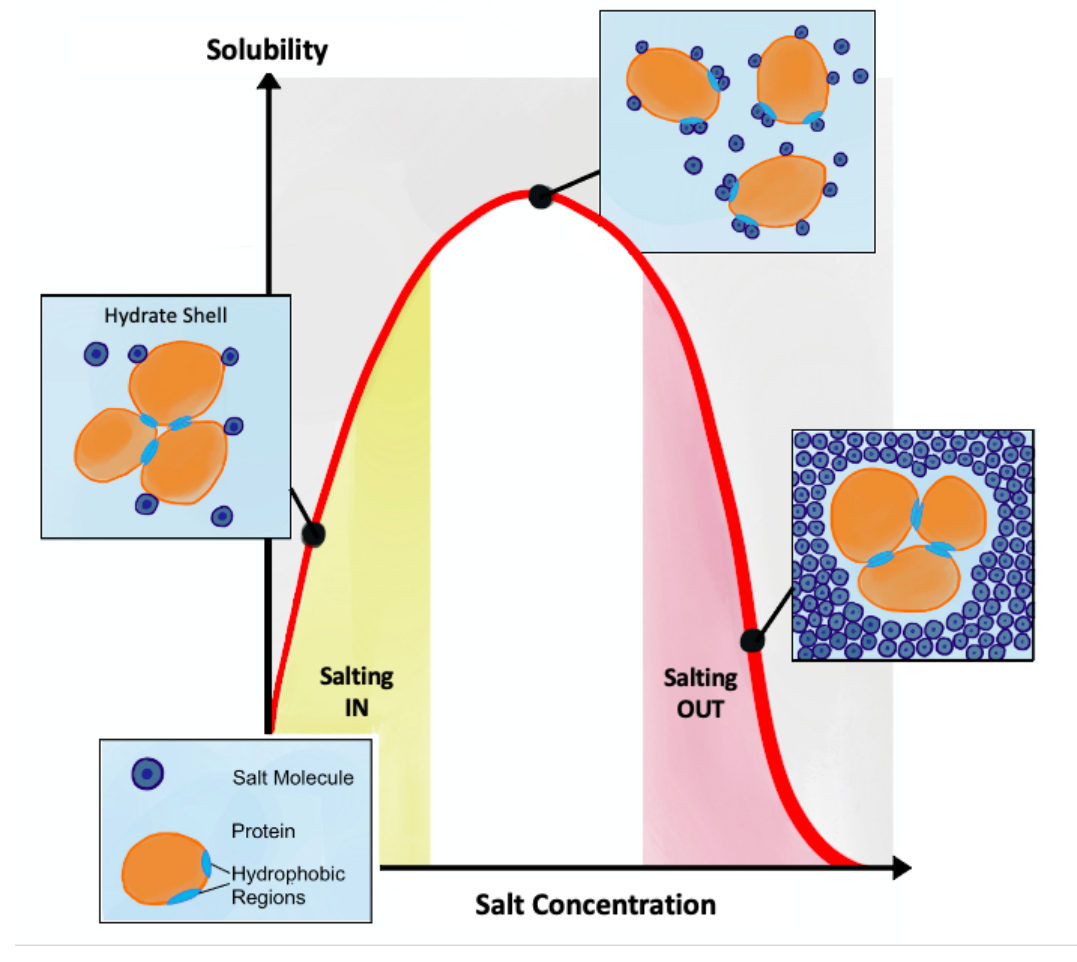
蛋白质存在盐溶和盐析,其原理是盐粒子会附着在蛋白质表面,优先覆盖疏水部分。在低浓度下提高了蛋白质的溶解度,发生盐溶,高浓度下降低了蛋白质的溶解度,发生盐析。
蛋白质的变性与复性
在某些物理和化学因素作用下,蛋白质特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构,从而导致其理化性质改变和生物活性的丧失。
蛋白质变性的本质是破坏非共价键和二硫键,不改变蛋白质的一级结构。
蛋白质的变性因素多种多样,包括有加热、乙醇等有机溶剂、强酸、强碱、重 金属离子及尿素、盐酸胍、SDS等。
Note
蛋白质变性不一定沉淀,蛋白质沉淀也不一定变性。
若蛋白质变性程度较轻,去除变性因素后,蛋白质仍可恢复或部分恢复其原有的构象和功能,称为复性(renaturation)。
Note
蛋白质的复性说明蛋白质的高级结构是一级结构决定的,蛋白质的一级结构没有被破坏,则蛋白仍能重新折叠(甚至自发折叠)为完整的高级结构。
蛋白质紫外特征吸收峰
蛋白质呈色反应
蛋白质N-端氨基与赖氨酸侧链氨基发生茚三酮反应会生成蓝紫色化合物,这是氨基酸的特征定量反应,生成的有色物质最大吸收峰在570nm附近,可作为氨基酸定量分析方法。
蛋白质和多肽分子中肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色,此反应称为双缩脲反应,双缩脲反应可用来检测蛋白质水解程度。
蛋白质研究方法
蛋白质的提纯、检测的基本流程如下:
在这其中,蛋白的分离纯化有如下常用方法:
- 盐析可以纯化和浓缩蛋白质
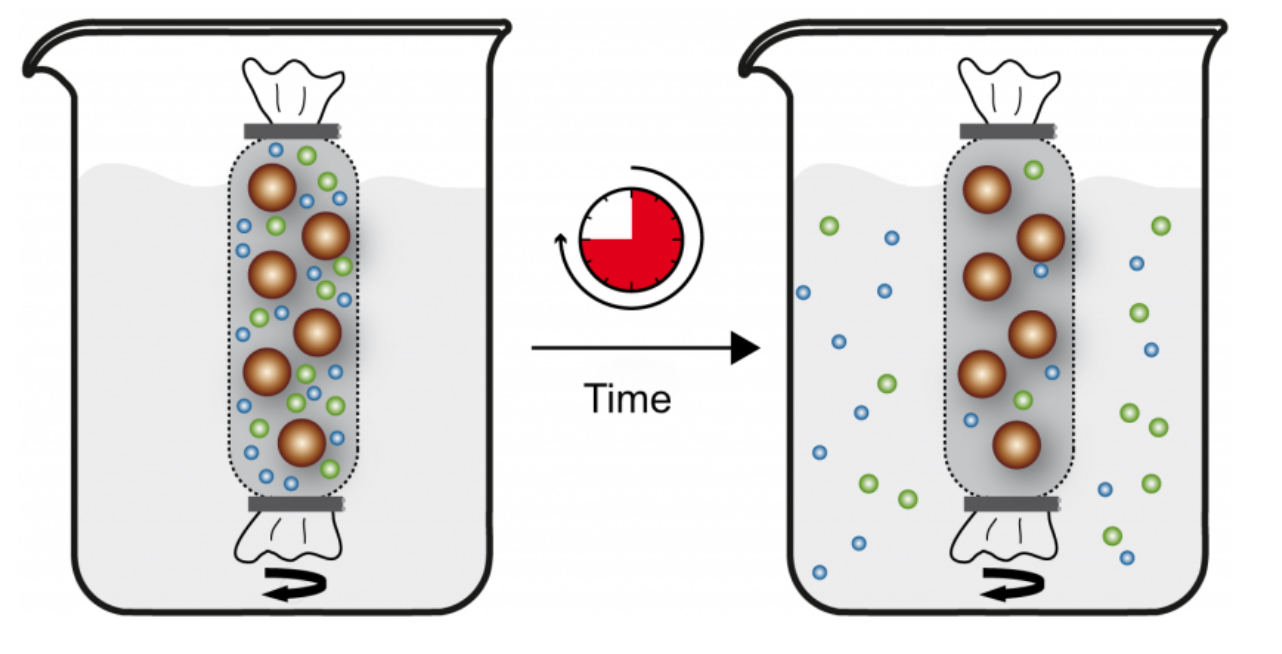
- 透析可以去除蛋白质里的小分子物质
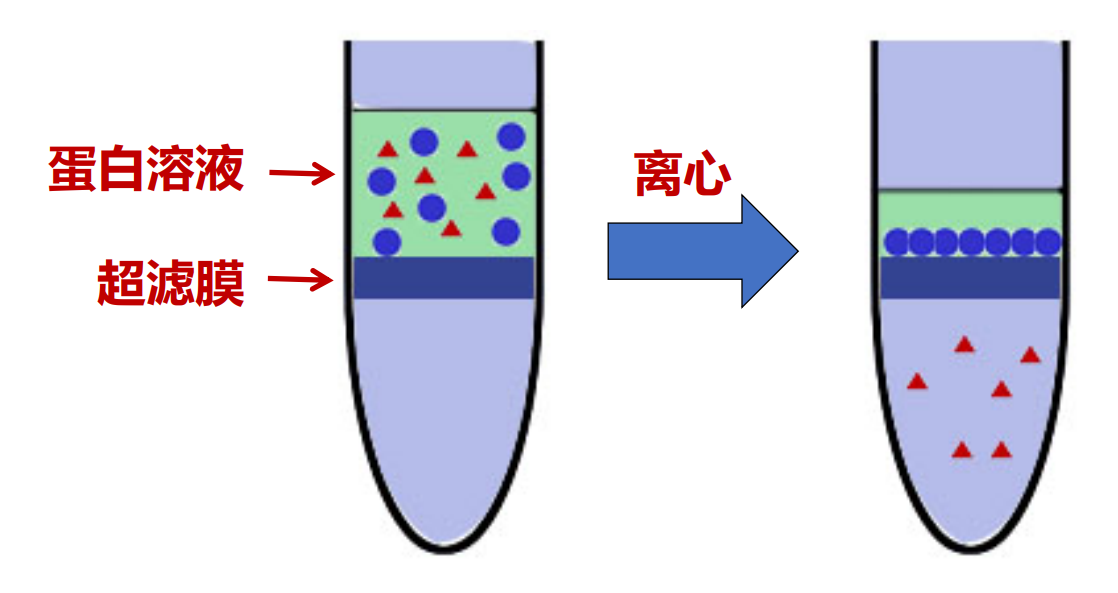
- 超滤可以浓缩蛋白质和去除小分子物质
- 亲和层析灵活多变(在目的蛋白末端加上6-10个组氨酸序列实现筛选)
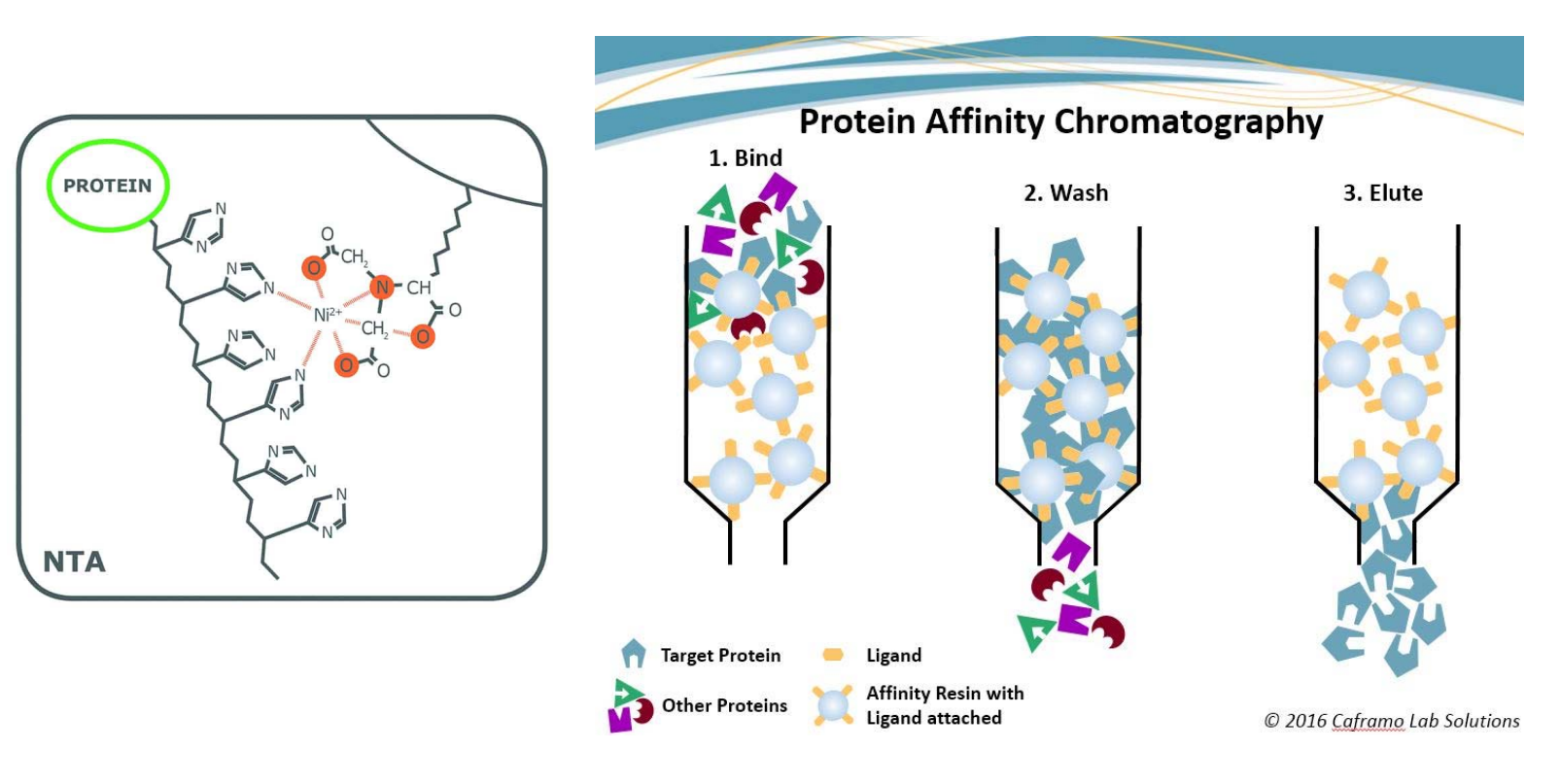
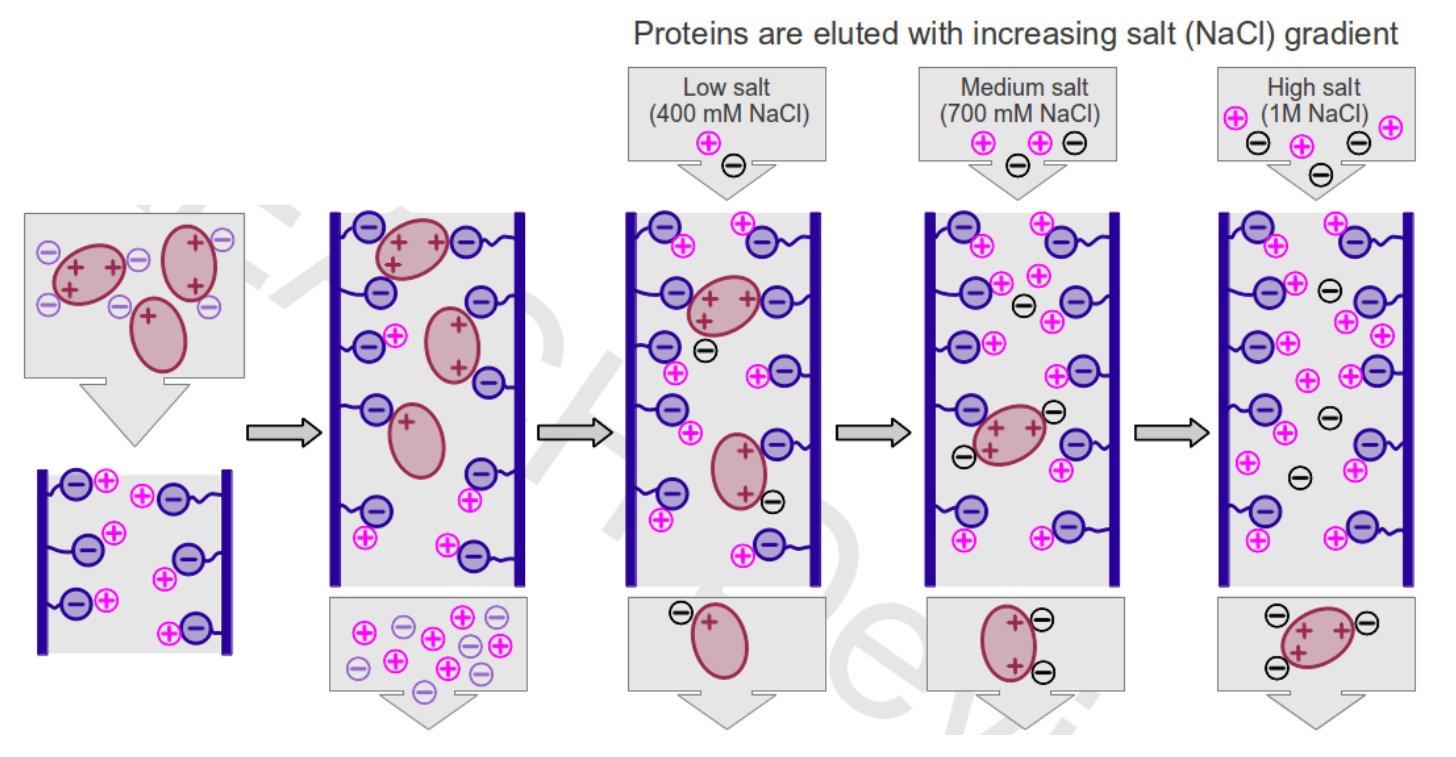
- 离子交换层析根据蛋白质所带电荷的性质和大小进行分离
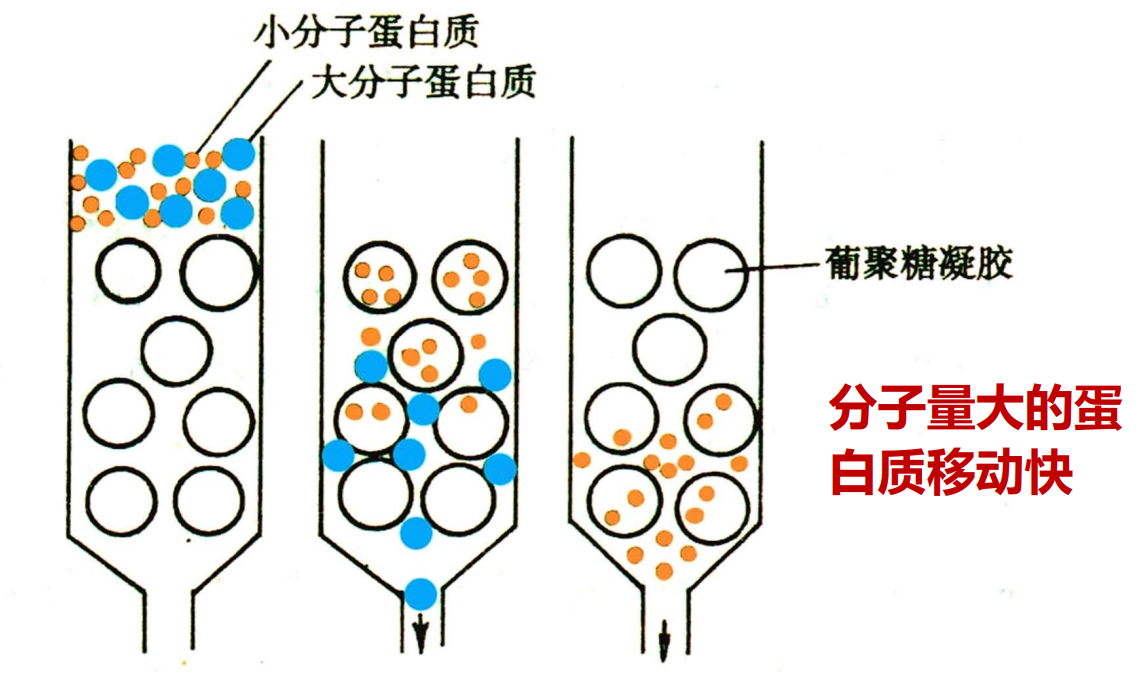
- 凝胶过滤层析(分子筛)根据蛋白质分子量大小进行分离
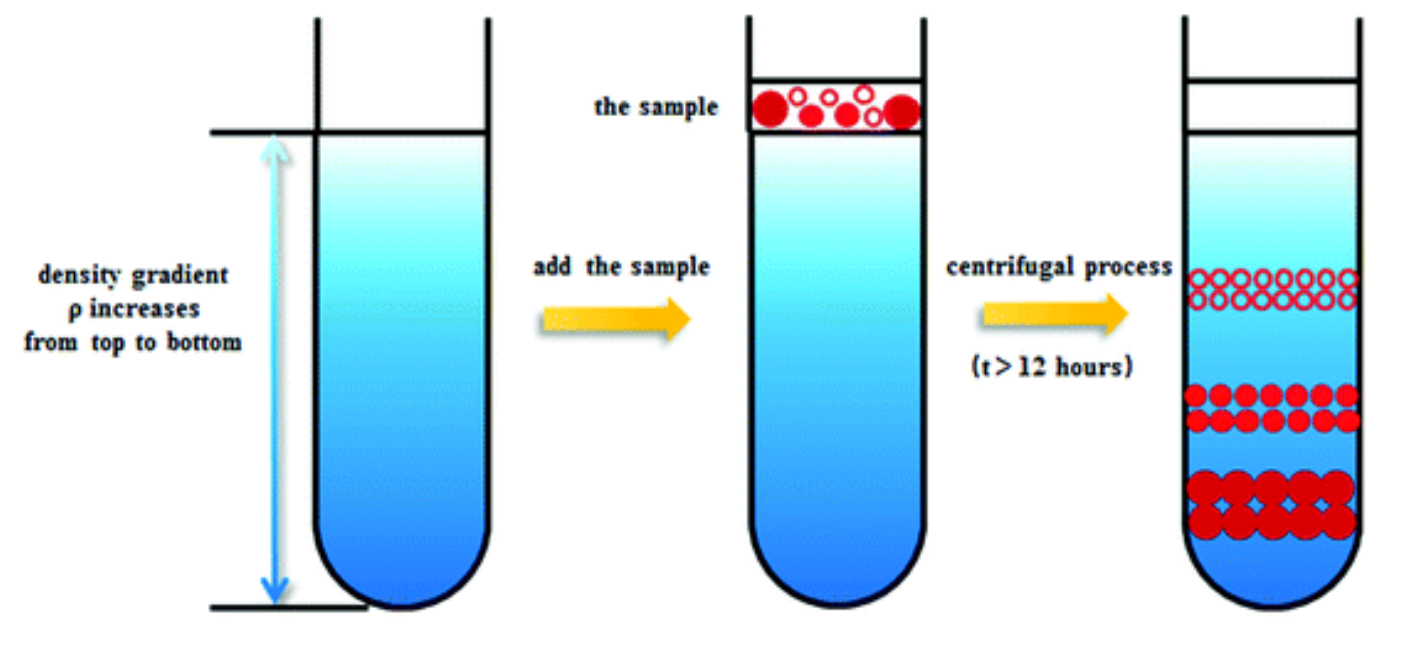
- 超速离心可以纯化蛋白质和估计蛋白质分子量
- 电泳是蛋白质分离和鉴定的常用方法
- SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE):常用于蛋白质分子量测定
- 等电聚焦电泳( IEF):根据蛋白质等电点的差异分离蛋白质
- 双向凝胶电泳(2-DE):蛋白质组学研究的重要技术