细胞内膜系统与囊泡运输
内膜系统
内膜系统是位于细胞内的,在结构、功能乃至发生上有一定联系的膜性结构的总称。其包含内质网、高尔基复合体、溶酶体、过氧化 氢体及。
内质网
内质网,Endoplasmic Reticulum(ER),主要被分为两个部分,粗面内质网(rough ER)与光面内质网(smooth ER),两者在结构与功能上均有所不同。

粗面内质网的胞质侧附着有有很多核糖体,而光面内质网上没有。
通常光面内质网呈现出管状网络的结构,而粗面内质网则多是扁平囊状的结构。
粗面内质网与光面内质网通常相互连接,由粗面内质网合成的蛋白质与膜会转移至光面内质网,再转移至其他部位。
ER内含有大量的酶,涉及到蛋白质折叠、药物解毒、膜脂质生物合成、胆固醇和脂肪酸代谢等。

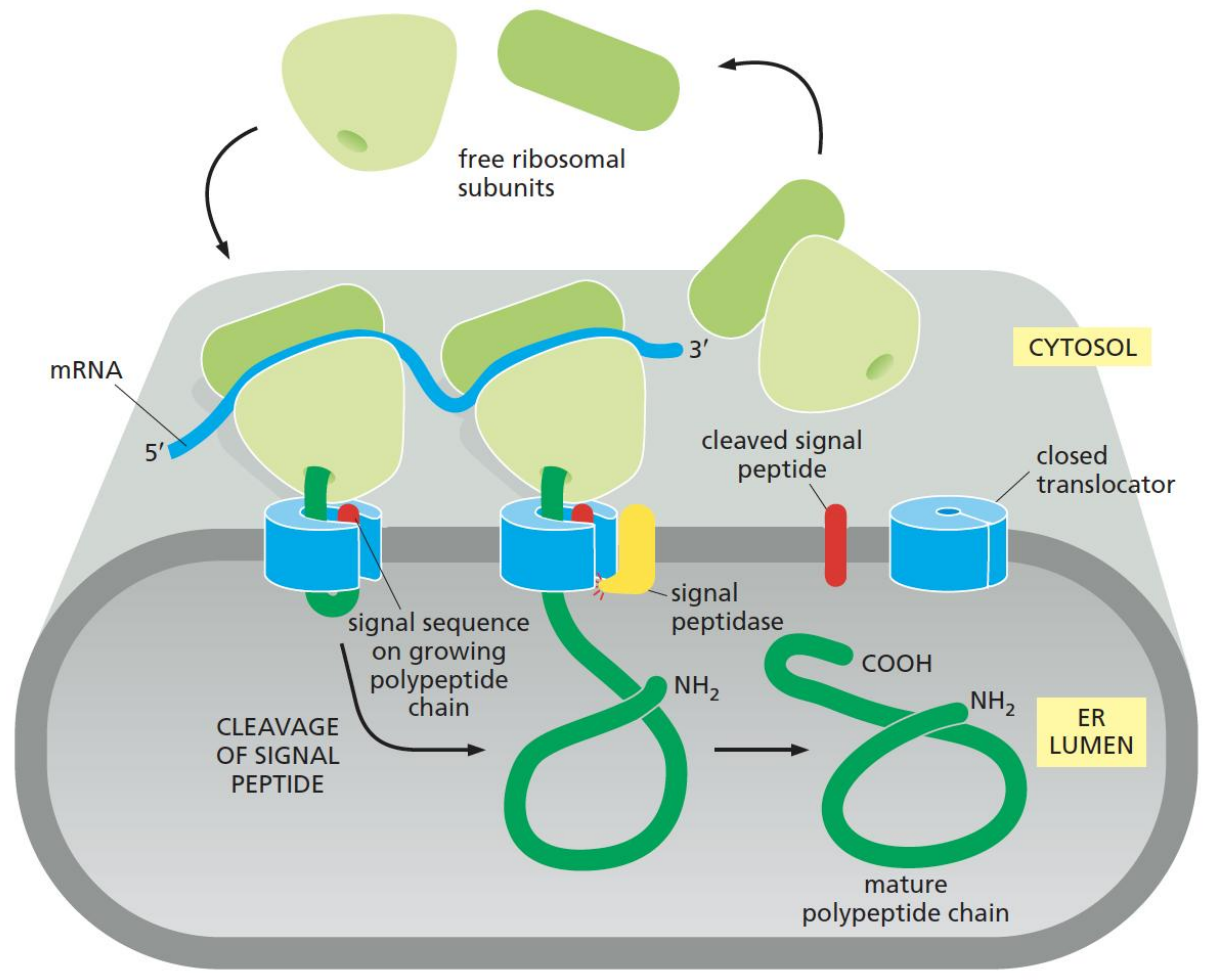
ER也是蛋白质分选的起始点。蛋白质的靶向运输由其肽链上的信号肽主导,其引导膜蛋白质以正确的方向被插入内质网膜中(膜蛋白质在膜上的拓扑学取向已经在内质网中得以确立),或者引导分泌蛋白进入到内质网管腔内等待分泌。
内质网还是细胞内重要的钙库,同时为许多细胞器提供生物膜。
内质网压力与许多人类疾病息息相关。
高尔基体
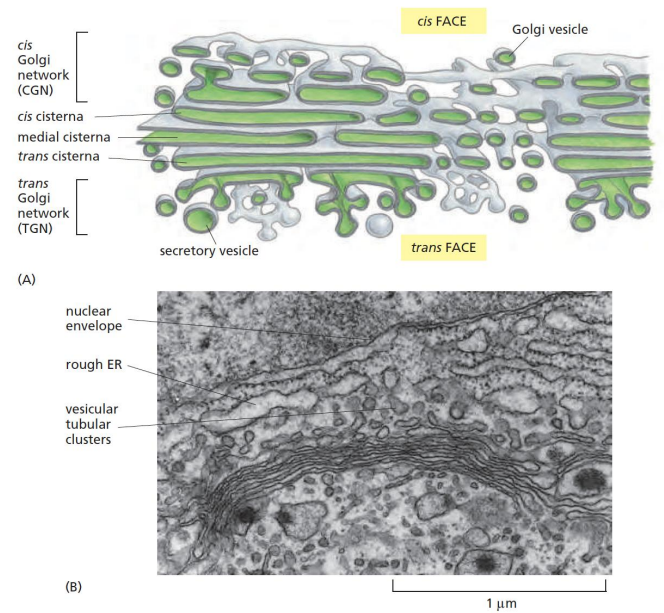
高尔基体就像一个千层饼一样,由层层叠叠的片状、囊状膜结构堆叠起来,其可以被分为五层结构:
- 顺面高尔基体网络 (CGN)
- 顺面潴泡
- 中间潴泡
- 反面潴泡
- 反面高尔基体网络 (TGN)
其中面向内质网一侧的被称为顺面(cis FACE),而面向质膜一侧则称为反面(trans FACE),前者突起,后者凹陷,使得高尔基体整体“弓向”内质网。
高尔基体主要化学组成为:
- 蛋白质:60%
- 低于内质网膜,高于细胞膜,含有多种酶类。标志性的酶为糖基转移酶。
- 脂类: 40%
- 卵磷脂(磷脂酰胆碱)介于内质网膜与细胞膜之间。
高尔基体是蛋白质分选的物流中心,其不仅承担进一步分选运输蛋白的职责,还需要对各个蛋白做进一步的加工。其至少包括蛋白质糖基化、溶酶体酶的甘露糖-6-磷酸化和分泌性蛋白的水解。
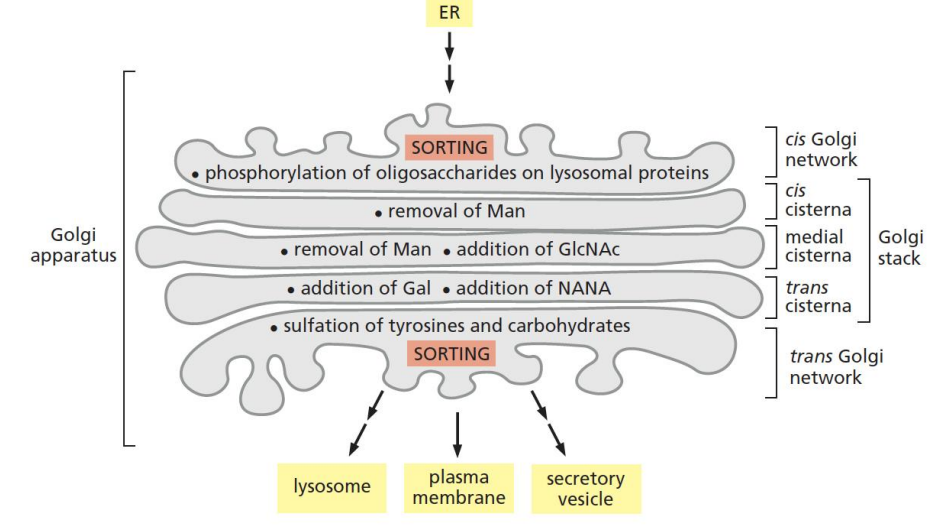
高尔基体还是重要的胞内天然免疫反应中心。
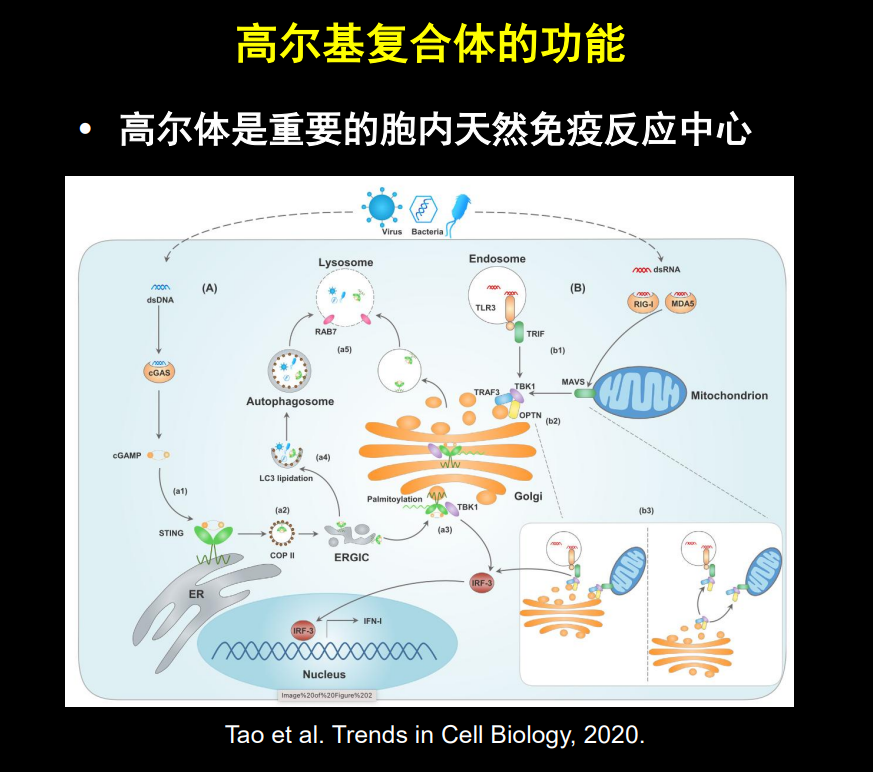
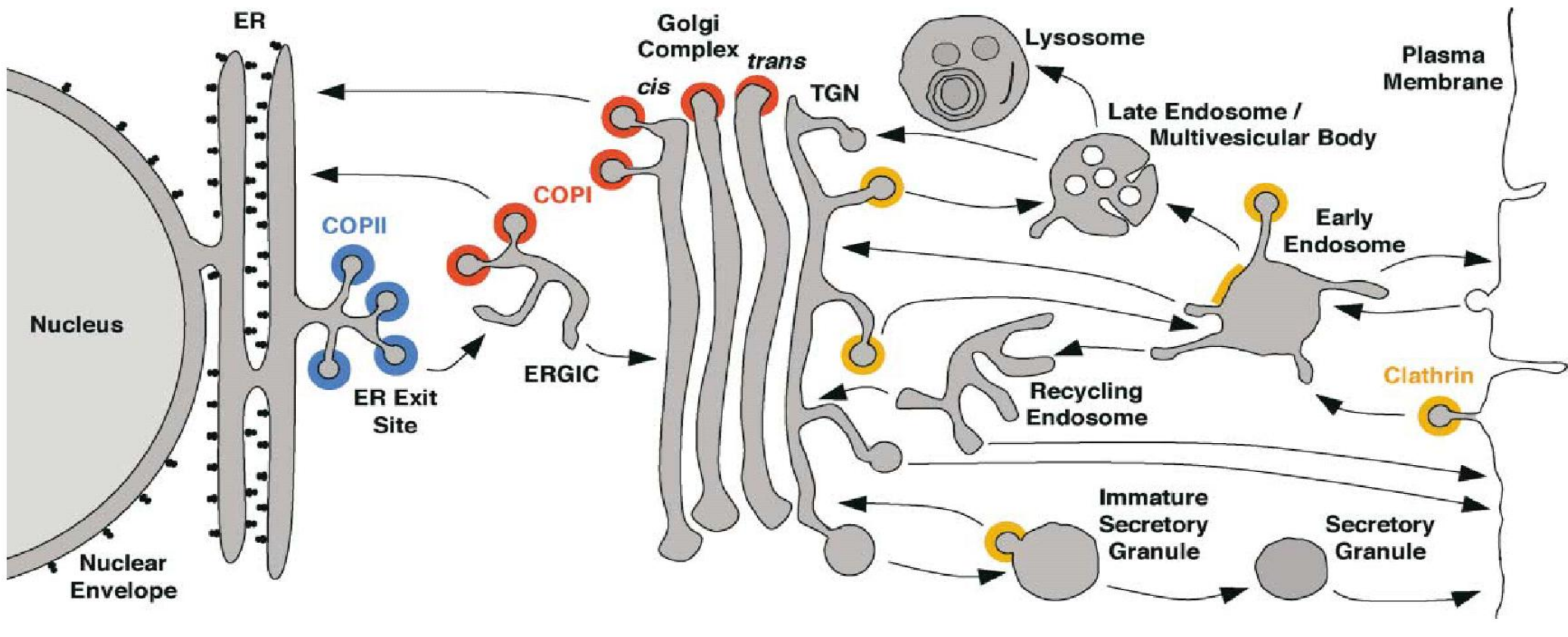
高尔基体和内质网之间的区域被称为ERGIC,它是一个临时的结构,从内质网来的囊泡会在这里融合入ERGIC,其中的蛋白质会被再次打包为囊泡,继续运往高尔基体。
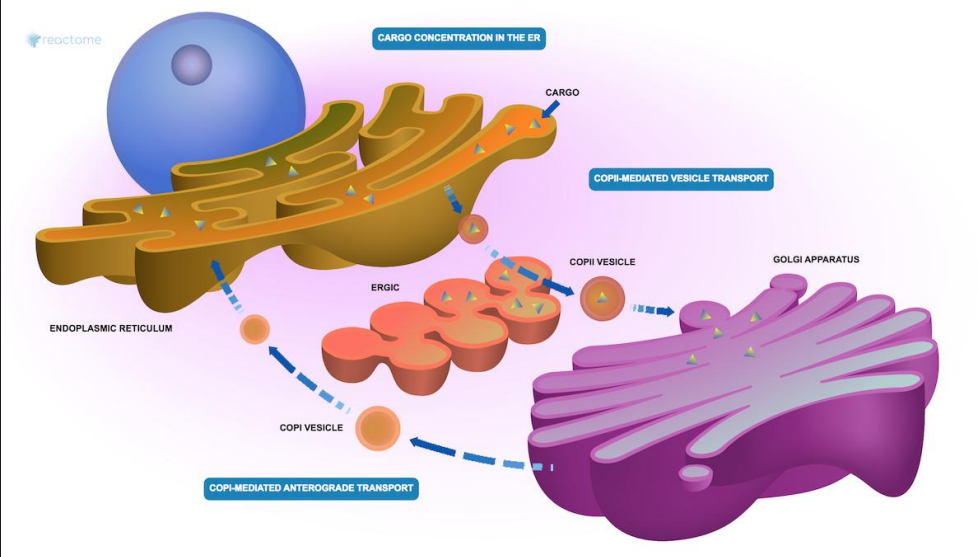
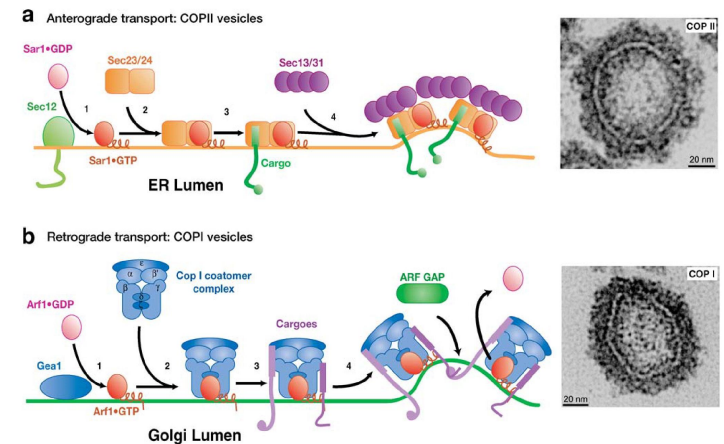
在高尔基体的顺面和内质网之间存在双向运输,从内质网运输至高尔基体及其反向运输分别由COPII和COPI包被蛋白介导,包被蛋白包裹在囊泡上,并在到达终点站后脱落,最终由SNARE蛋白像拉链一样将囊泡融入膜结构中。
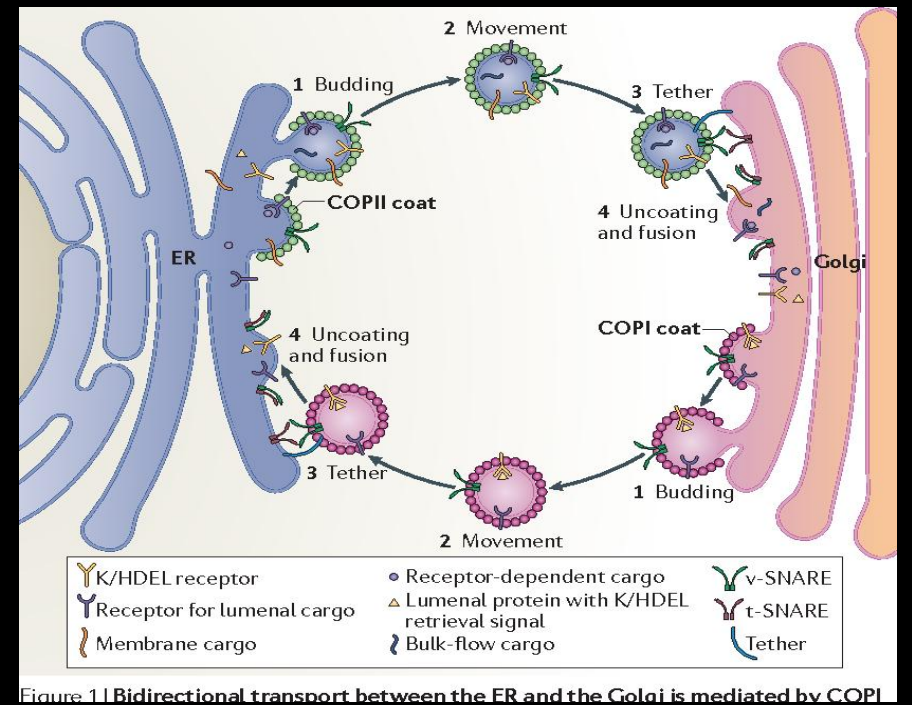
高尔基体的反面也能分泌大量囊泡,其将经过高尔基体修饰过后的蛋白运送至膜上或者膜外(胞吐作用)。
这种分泌主要用两种模式——组成性分泌与调节性分泌,前者是一种持续不断的,无特定信号依赖的分泌方式,后者是一种按需分配,信号依赖的分泌方式(比如特定的激素、神经递质刺激)。
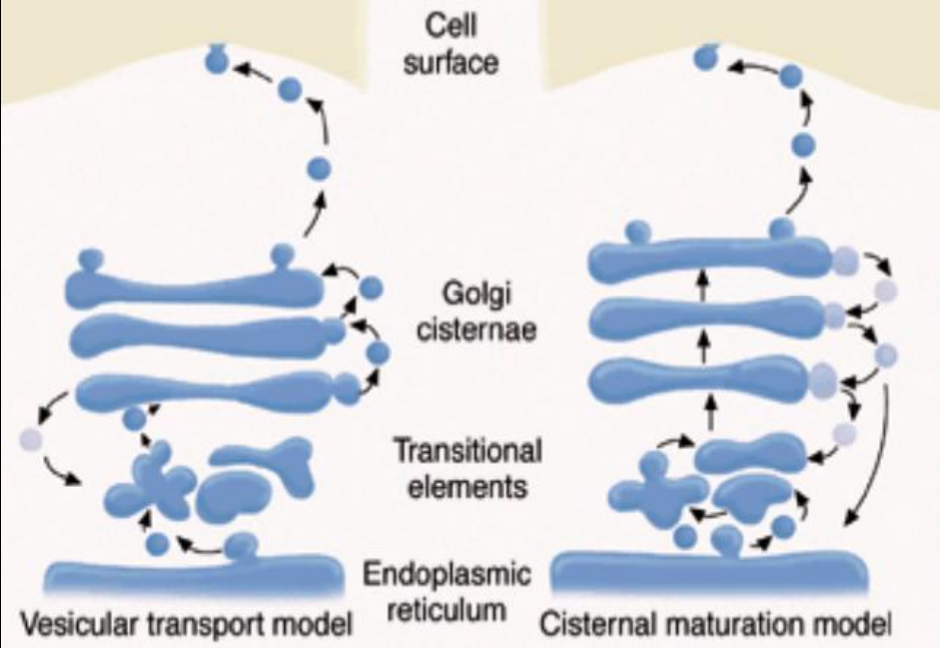
高尔基体工作模型
目前有两种模型来解释高尔基体的工作原理:
- 囊泡运输模型:该模型认为高尔基体的潴泡是稳定的结构,蛋白质主要通过囊泡在各层之间运输。
- 潴泡成熟模型:该模型认为高尔基体的潴泡是不稳定的,内质网来的囊泡聚合成顺面潴泡,然后该潴泡在迁移至反面的过程中逐渐成熟,其内蛋白质也在不断变化。而各层之间的加工酶通过逆向运输在各层之间转运。
现在一般认为潴泡成熟模型是更符合实验结果的模型。参考链接: https://www.nature.com/scitable/topicpage/how-do-proteins-move-through-the-golgi-14397318/
溶酶体
溶酶体是一种含有丰富水解酶的细胞器,溶酶体内通过质子泵维持着比细胞质基质更低的pH来维持水解酶的活性。
溶酶体参与许多重要的细胞内消化——吞噬作用、内吞作用与自噬作用。
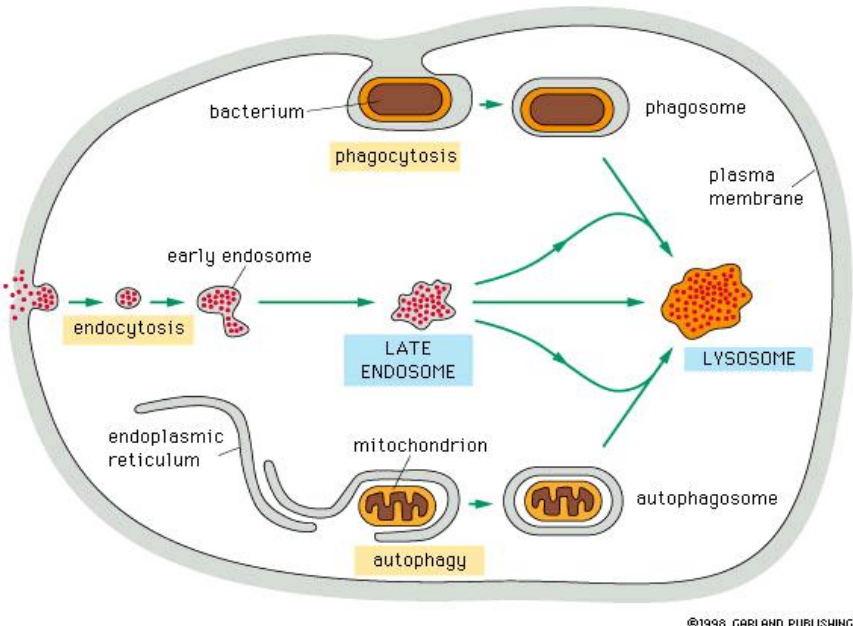
三种途径
- 吞噬作用:主要针对细胞吞下的“大颗粒”物质,比如细胞碎片、细菌等。细胞膜通过伪足包裹住一个细菌后内吞形成吞噬体,再与溶酶体融合分解细菌。
- 内吞作用:细胞摄取小分子物质与液体的过程,这个过程主要由内体介导,一开始细胞膜内陷,吞入分子物质形成早期内体,最后晚期内体与溶酶体融合消化外界分子。
- 自噬作用:细胞会淘汰衰老的细胞器,比如将衰老的线粒体用内质网膜包裹后形成一个自噬体交由溶酶体分解。
溶酶体主要功能有:
- 细胞内消化
- 膜修复
- 病原体入侵防御
- 骨基质重吸收
- 抗原呈递
- 胆固醇转运
- 细胞自噬
同时,溶酶体还是重要的细胞内信号中枢,它至少参与到了以下过程的信号调控:
- 溶酶体内酸性维持
- 细胞内营养感知
- 细胞内定位与细胞器互作
- 细胞器身份标识(促进正确的膜融合)
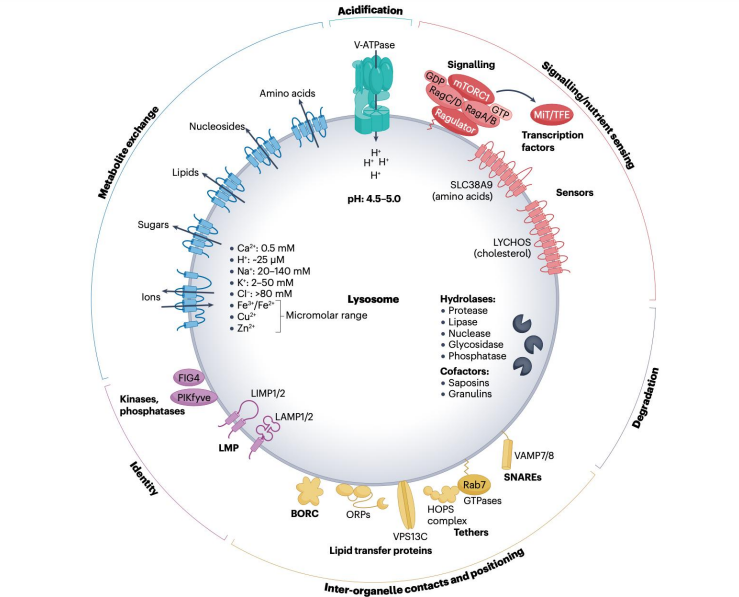
同时细胞对溶酶体也有多种调控手段,溶酶体会因为质子泵被抑制、膜结构被破坏、膜稳定蛋白Hps70被抑制或者其他因素被破坏。而可以通过加强Hps70作用,或者通过转录因子TFEB激活CLEAR基因网络来生成更多溶酶体。
溶酶体同样存在溶酶体自噬,旨在通过正常的溶酶体清除已经受到损伤的溶酶体,保持细胞内稳态。
与溶酶体相关的疾病包括溶酶体储积症、类风湿性关节炎和矽肺等等。
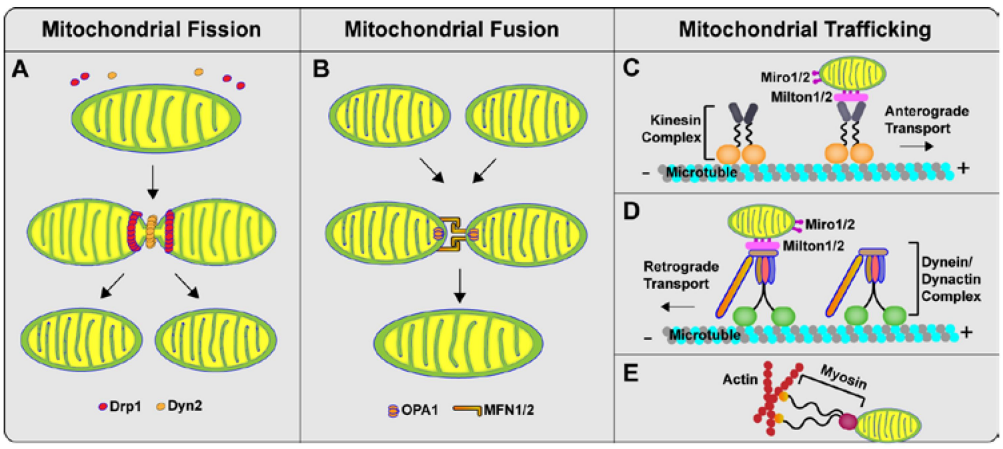
线粒体
线粒体是一类含有DNA的,拥有一定自我合成蛋白能力,可以自我复制DNA的半自主细胞器。
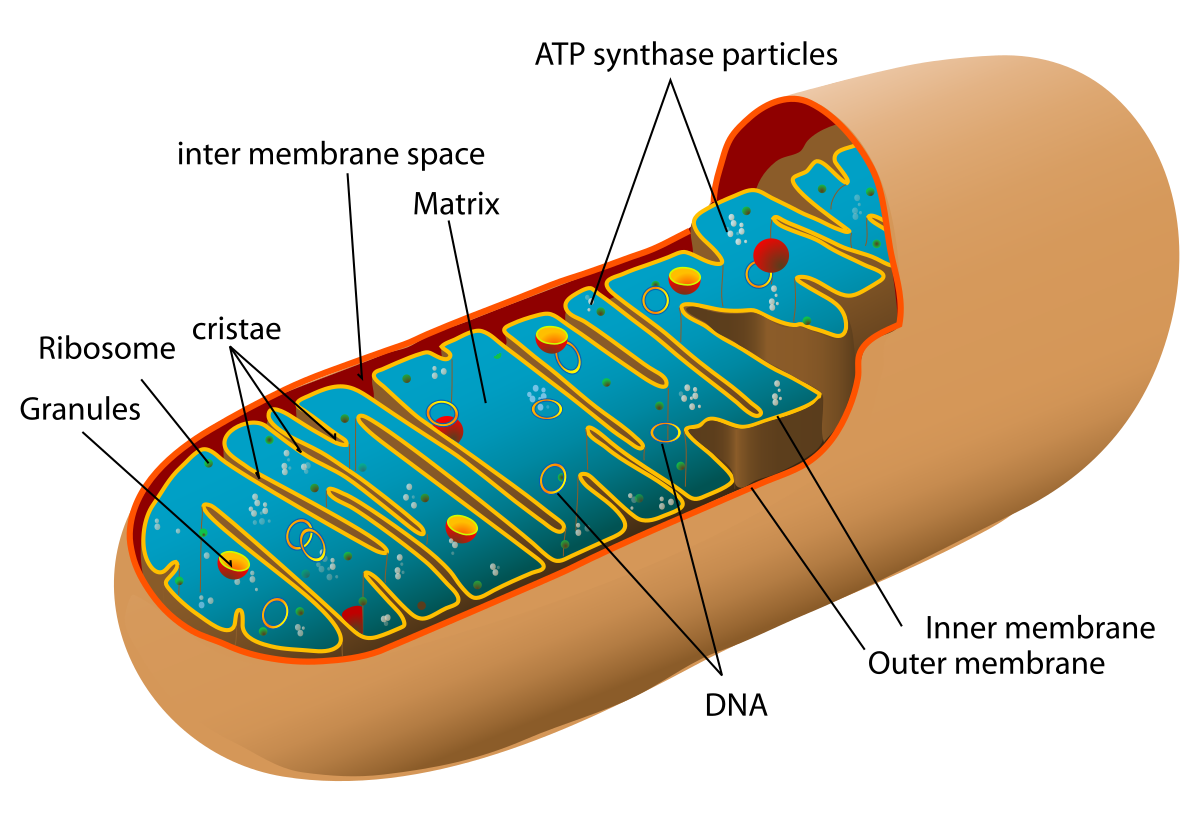
线粒体的结构不是静态的,在细胞内其会发生分裂、融合与迁移。
囊泡运输
囊泡运输的四个关键:
- 囊泡形成
- 分选信号
- 运载蛋白
- 膜融合
最简单的囊泡运输模型只需要两步:出芽与融合。
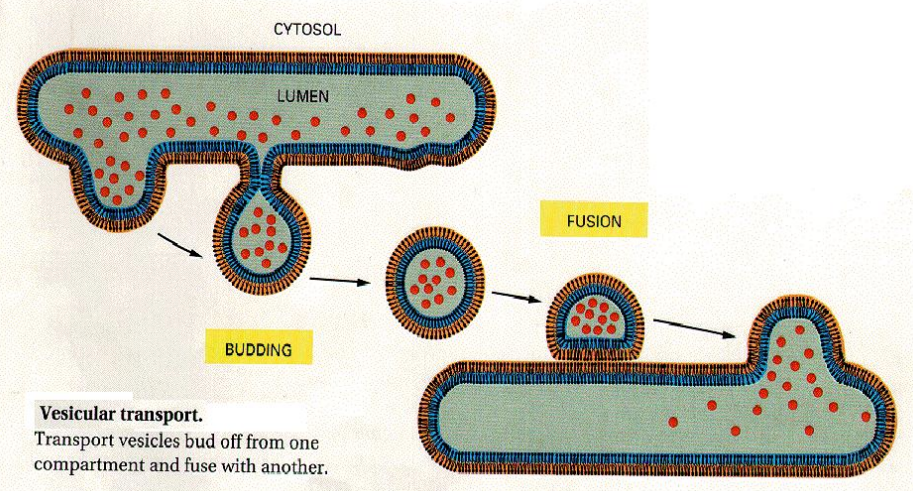
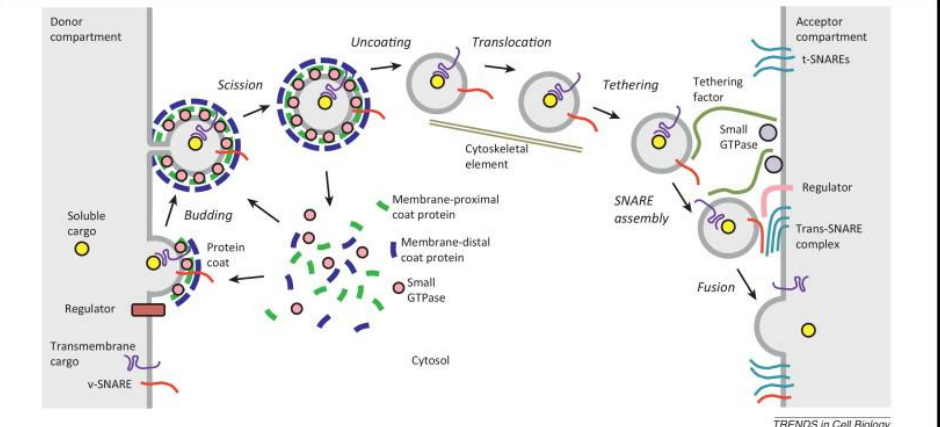
这构成了囊泡运输的底层逻辑,而在细胞中,为了满足其复杂的运输需求,兼具稳定性,便利性,则会对囊泡运输进行一系列改造:
- 发货阶段:供体区室需要运输的蛋白被分拣出来,小GPTase激活后招募包被蛋白,连同膜上v-SNARE一起打包。
- 颈切:包被蛋白使膜变形突起,由特定蛋白切断,完成出芽。
- 囊泡形成后包被蛋白脱落,暴露出v-SNARE用于识别囊泡目的地。
- 转运:囊泡被马达蛋白牵着,通过细胞骨架运输。
- 拴系:受体区室附近,囊泡通过拴系因子与目标膜接触,由小GTPase调控。
- 融合:v-SNARE与目标膜上t-SNARE识别后形成反式SNARE复合物,将囊泡与目标膜拉进,最后融合,
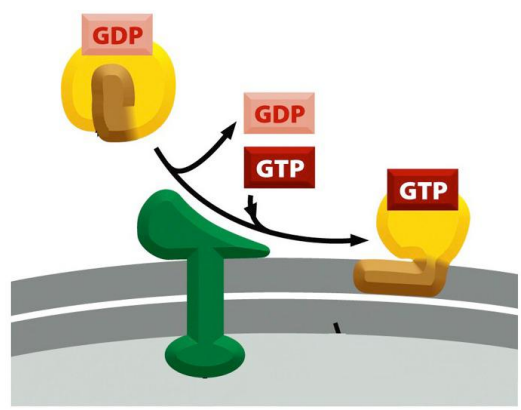
招募
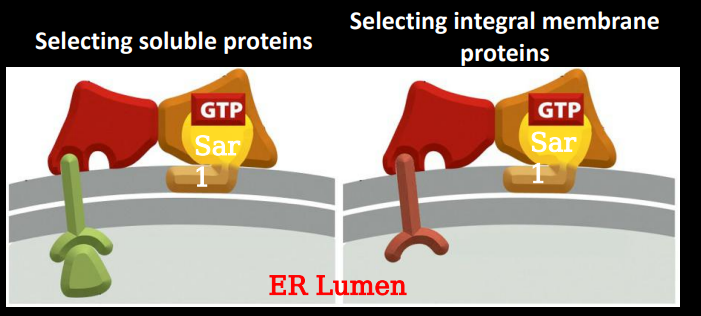
发货阶段对包被蛋白招募主要涉及到小GTPase的激活,其上GDP被GEF换成GTP以固定在膜上,成为包被蛋白的停泊位点。
包被蛋白会检查囊泡内的蛋白是否是要运载的货物。
下图则详细展示了两种包被蛋白的招募与组装过程:
当然,运输过程不仅要解决“怎么送”,还要解决“送去哪”的问题,通常在内质网中,需要被转运的蛋白上会带有特殊的ER export signals——几个特定的氨基酸序列,有这些氨基酸序列的蛋白会被包被蛋白识别并将其纳入转运的行列。
Note
下划线标记的氨基酸残基是蛋白质从内质网(ER)输出所必需的。序列编号从C端开始,其中C端末端对应于 −1。
同时,对于跨膜蛋白来说,其跨膜段长度也会决定它的命运。在高尔基体停留的跨膜蛋白往往有着比质膜上跨膜蛋白更短的跨膜但(因为高尔基体的膜更薄)。
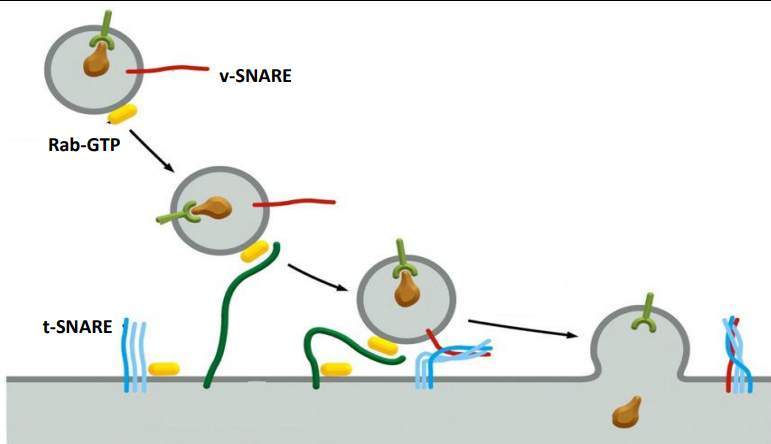
而终点站的识别问题也是关键,这在前文已有所提及,关键就是Rab-GTP蛋白与v-SNARE蛋白.
Rab-GPT蛋白会被目标膜上的拴系蛋白捕获,之后v-SNARE与t-SNARE会相互识别,一旦识别成功就会迅速缠绕为紧密的四螺旋束,释放出的能量将囊泡拉进目标膜,排开水分子,迫使两者融合。
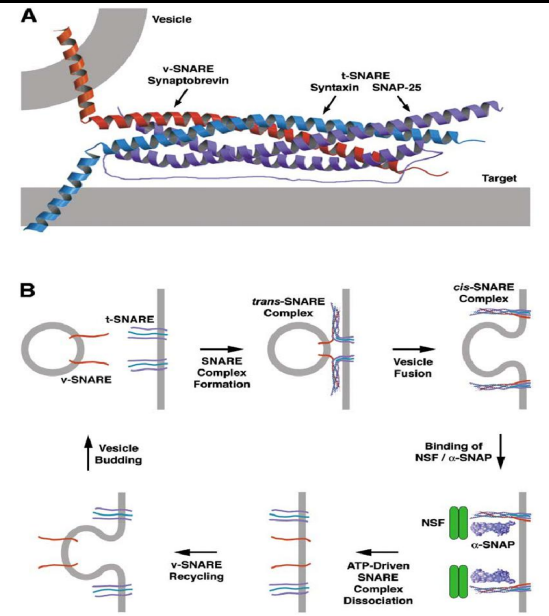
v-SNARE/t-SNARE
v-SNARE和t-SNARE缠绕后是无法自行解开的,需要在NSF和SNAP蛋白的协助下,利用ATP水解释放的能量复原,使得SNAREs可以被回收用于下一次运输。
溶酶体酶的特殊命运
溶酶体酶是囊泡运输中很特殊的存在,它们的分选方式在高尔基体中与其他蛋白被区分开来,方式是给它们打上甘露糖-6-磷酸,在TGN中有专门的M-6-P Adapter识别这样的信号,将蛋白分选至溶酶体。